礼赞建党百年 守护人民健康|储天晴教授:“新肺辅之言”为早期NSCLC带来更多生存获益

肺癌是全球范围内发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(NSCLC)是肺癌中的最常见病理类型。近年随着靶向药物与免疫检查点抑制剂的快速发展,新辅助免疫治疗得以在临床中广泛应用且表现尤为突出,目前针对NSCLC 的新辅助免疫治疗方式的临床研究已成为热点。在免疫治疗新浪潮中,肺癌治疗常联合化疗、放疗、免疫治疗等多种手段,评估新治疗方案的安全性和制定合理防治策略从而提高患者的整体获益尤为重要。我们特别邀请到上海交通大学附属胸科医院储天晴教授和大家谈一谈免疫治疗在早期肺癌领域的新进展和FN管理新挑战。
NSCLC新辅助免疫治疗初露锋芒且未来可期
手术是早期NSCLC的主要治疗手段,但术后复发率高;新辅助化疗可以降低肿瘤大小,为更多患者争取手术机会,但在降低术后复发率方面收效甚微。与新辅助化疗相比较,新辅助免疫治疗除缩小肿瘤体积外,还可以增强针对肿瘤抗原的全身T细胞应答,增强对未转移肿瘤的识别和杀伤,从而降低术后复发风险,其疗效和延迟复发的能力更强[1]。在新辅助治疗领域,已有多家医药公司先后开展新辅助免疫治疗的Ⅰ和Ⅱ期临床试验,以术后病理缓解情况为主要观察指标,主要病理缓解(MPR)和病理完全缓解(pCR)为主要评价标准,对治疗模式(单药、双免疫、免疫联合化疗)、治疗疗程、不同分期患者的入组等进行了探索,发现免疫联合化疗是新辅助免疫治疗的最优治疗模式,可以让患者获得更高的MPR率(可达到80%以上)[1]。目前正在进行的多项新辅助免疫治疗Ⅲ期临床试验均采用免疫联合化疗的模式,以期为NSCLC新辅助免疫治疗临床实践提供更多证据。
Checkmate-816研究数据支持新辅助免疫联合治疗应用于Ⅰb-Ⅲa期NSCLC患者
Checkmate-816是目前新辅助免疫治疗领域首个公布阳性结果的研究。该随机对照Ⅲ期临床试验入组了358例Ⅰb-Ⅲa期NSCLC患者,接受纳武利尤单抗联合化疗或单用化疗术前新辅助治疗三周期,在治疗后六周内行手术治疗。其主要研究终点是pCR率和无事件生存期(EFS)[2]。意向治疗人群pCR率为24%,化疗组仅为2.2%;根治性手术患者中免疫联合化疗组和化疗组pCR率(30.5% vs 3.2%)差异更为显著,具有显著统计学意义。数据显示,驱动基因阴性患者均可选择免疫联合化疗新辅助治疗手段,所有亚组人群均能从免疫联合化疗中获益,Ⅰb-Ⅲa期患者pCR率均明显提高,其中Ⅲa期患者中位残余活肿瘤细胞比率(RVT)更低,Ⅲa患者的获益更加明显(图1)[2]。Checkmate-816研究中免疫联合化疗组1/3的患者达到pCR率,是远高于化疗时代pCR率的“新突破”。
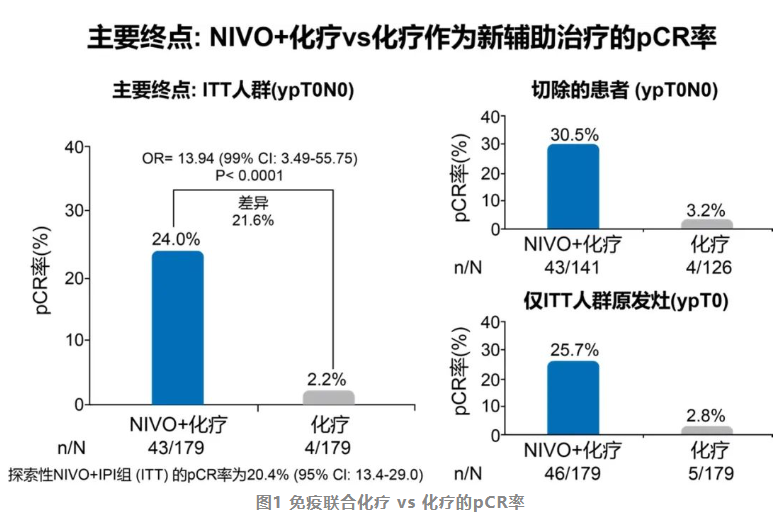
NSCLC新辅助免疫联合治疗不影响后续手术的实施
Checkmate-816研究表明,相较于化疗组,免疫联合化疗不会降低手术可行性、延误手术时机、增加手术难度和术后并发症,尚无证据表明其会妨碍后续手术的实施。在手术可行性和手术时机方面,免疫联合化疗组中,Ⅰb期和Ⅲa期患者接受手术的比例分别为85%和83%,化疗组接受手术的比例分别是22%和72%[2];免疫联合化疗后手术取消和延迟的比例未增加,可接受手术的比例较化疗组有显著提升(图2)。
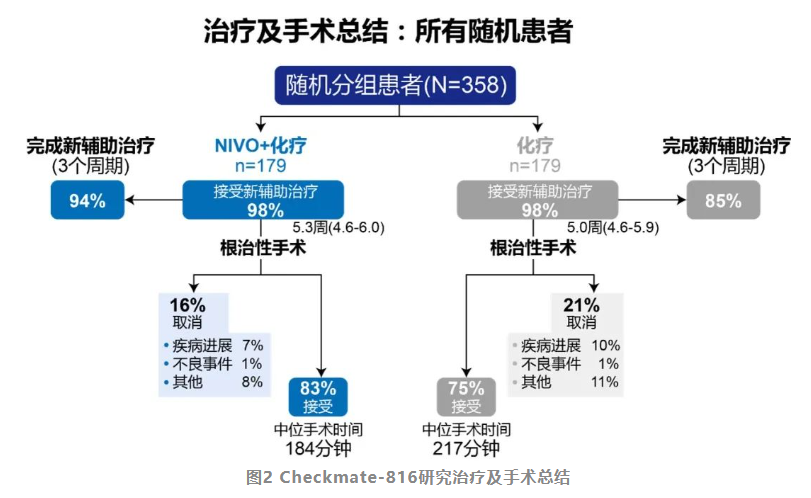
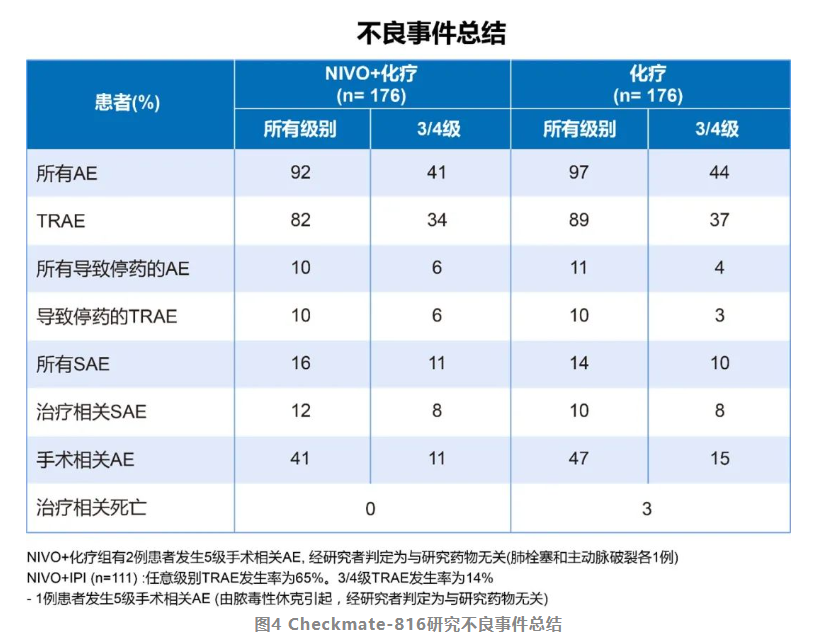
在手术难度方面,免疫联合化疗组和化疗组的R0手术切除率(83% vs 78%)相近,甚至高于化疗组;手术方式上免疫联合化疗组微创手术比率更高,化疗组开胸手术和全肺切除术比率更高(图3)[2]。在术后并发症方面,免疫联合化疗组和单用化疗组3-4级手术相关AE分别为11%和15%,两组中位住院时间均为10.0天[2],免疫联合化疗未增加术后的并发症,也未延迟患者的住院时间(图4)。

新辅助免疫联合治疗展望:破FN管理新挑战,完善NSCLC治疗模式革新
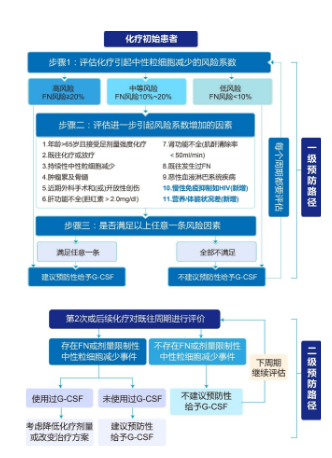
图5 化疗相关中性粒细胞减少的预防、治疗原则
新辅助免疫联合治疗引发的新思考
早期NSCLC围手术期新辅助免疫治疗适宜人群的选择如何考虑?目前早期NSCLC围手术期新辅助免疫治疗联合化疗的Ⅲ期临床研究入组患者多为Ⅱ-Ⅲ期[1][2][3],Checkmate-816研究入组了Ⅰb期患者[2];尽管2020年《NSCLC术前新辅助免疫治疗专家共识》推荐可切除Ⅰb-Ⅲa期NSCLC患者可考虑术前使用新辅助免疫治疗±含铂双药化疗,但目前对于Ⅰb期患者争议较大,不建议临床作为常规推荐使用。pCR能否作为NSCLC新辅助免疫联合化疗的替代终点?既往化疗时代NSCLC新辅助化疗中位pCR仅4%[4],使用MPR作为替代终点。CheckMate 816研究中pCR(24% vs 2.2%)[2]呈现“高值”,目前认为pCR可作为新辅助免疫联合化疗试验的一个替代终点。达到pCR 后是否需要进行辅助免疫治疗?Checkmate-816研究结果表明ctDNA清除率越高的患者获得了更高的pCR率[2],但理论上达到pCR、肿瘤被完全切除,并不等于体内所有肿瘤ctDNA 已被清除。既往多项临床试验和meta分析证实[3][4][5],NSCLC根治性切除后使用ctDNA检测出MRD与更高的复发和死亡风险相关,且使用ctDNA检测出MRD优于传统临床影像学方法鉴定出有疾病复发的患者,是指导术后是否需要辅助治疗的重要指标。在达到pCR且ctDNA完全清除的情况下,后续的辅助治疗确实帮助不大了,但现阶段的检测手段还不规范,达到pCR且ctDNA完全清除仍是一个理想化状态。所以达到pCR的患者是否需要进行辅助免疫治疗,目前无确切答案
总结
新辅助免疫联合治疗给早期NSCLC带来更多生存获益的同时,也给FN管理带来了新的挑战。免疫联合化疗新辅助治疗的疗效和安全性,其带来的生存获益优势有望改变可切除NSCLC患者的临床实践。随着生物技术的迅猛发展,每一种新治疗方案的诞生,都是对肺癌治疗模式的一次革新,如何转变治疗理念结合现有技术完善治疗方案,以最大化的实现患者长期生存,提升患者临床治愈,关注治疗相关不良反应的发生,提高患者整体获益,也是未来需要不断思考的课题。
1.Uprety D, Mandrekar SJ, Wigle D, et al. NeoadjuvantImmunotherapy for NSCLC: Current Concepts and Future Approaches. J ThoracOncol. 2020 Aug;15(8):1281-1297.
2.Jonathan Spicer, Changli Wang, Fumihiro Tanaka, et al. Surgical outcomes from the phase 3CheckMate 816 trial: Nivolumab (NIVO) + platinum-doublet chemotherapy (chemo)vs chemo alone as neoadjuvant treatment for patients with resectable non-smallcell lung cancer (NSCLC). Journal of Clinical Oncology 2021 39:15_suppl,8503-8503
3.Cao C, Le A, Bott M, et al. Meta-Analysis ofNeoadjuvant Immunotherapy for Patients with Resectable Non-Small Cell LungCancer. Curr Oncol. 2021 Nov 14;28(6):4686-4701.
4.Wu YL, Lu S, Cheng Y, et al. Nivolumab Versus Docetaxelin a Predominantly Chinese Patient Population With Previously Treated AdvancedNSCLC: CheckMate 078 Randomized Phase III Clinical Trial. J Thorac Oncol. 2019May;14(5):867-875.
5.Metzenmacher M, Hegedüs B, ForsterJ, et al. Combined multimodal ctDNAanalysis and radiological imaging for tumor surveillance in Non-small cell lungcancer. Transl Oncol. 2022 Jan;15(1):101279.
发表评论
最新评论


