礼赞建党百年 守护人民健康|杜瀛瀛教授:肺癌EGFR-TKI耐药后免疫治疗优势人群的探索

EGFR-TKI是晚期EGFR突变非小细胞肺癌的主要治疗手段,但几乎所有患者终因获得性耐药导致治疗失败,后继治疗陷入困境。对于EGFR-TKI耐药的患者,化疗被认为是主要的治疗方式,但疗效不理想。近年来,针对PD-1通路的免疫治疗在EGFR突变阴性肺癌患者中取得了突破性进展,而在EGFR-TKI治疗耐药患者中免疫治疗的疗效仍争议不断,需要进一步探索基于靶向治疗耐药机制和免疫微环境分型的PD-1抗体治疗优势人群,为EGFR-TKI耐药患者提供新的治疗方案。《医师报》特邀安徽医科大学第一附属医院医院杜瀛瀛教授探讨。
EGFR-TKI与EGFR-TKI耐药表皮生长因子受体(EGFR)基因是非小细胞肺癌(NSCLC)中最常见的驱动基因之一。中国NSCLC患者EGFR基因突变比例约为50%,对于EGFR突变阳性的患者,EGFR酪氨酸激酶抑制剂(TKIs)的疗效明显优于传统化疗,已作为EGFR敏感突变患者一线治疗的主要药物。
目前临床上广泛使用的EGFR-TKI主要有三代,第一代EGFR-TKI主要通过ATP竞争的方式可逆性阻断EGFR活性,包括吉非替尼、厄洛替尼、埃克替尼;第二代EGFR-TKI通过与EGFR的共价结合不可逆抑制EGFR激酶,包括阿法替尼、达克替尼;三代TKI的特点是除了不可逆抑制EGFR活化突变外,还可以克服T790M突变诱导的获得性一二代药物耐药机制,包括奥希替尼、阿美替尼、伏美替尼等。
然而接受EGFR-TKI治疗的NSCLC患者难以避免治疗后的获得性耐药。大多数患者服用一代或二代EGFR-TKI后第9-14个月后会产生耐药,EGFR的20号外显子T790M突变是最常见机制,发生率高达50%。以奥西替尼为代表的三代EGFR-TKI用于克服T790M突变介导的获得性耐药取得了显著疗效。但是患者在三代EGFR-TKI一线使用18.9个月以及二线使用约10个月后会再次出现继发性耐药。
目前研究发现三代药的耐药机制可以分为EGFR依赖型、EGFR非依赖型即旁路活化和组织学类型转化等其他机制,在一线应用和在T790M出现后的后线应用中耐药机制也不尽相同。一线应用时耐药机制较为复杂,59%的患者耐药机制并不清楚,旁路活化和组织学类型转化发生率更高,其中最常见的分别是MET扩增(15%)和小细胞肺癌(SCLC)转化。EGFR依赖性耐药途径发生率比较低,其中最常见的是C797S三次耐药突变,只占全部耐药机制的7%。后线应用中只有25%机制不明,已经明确的机制中,EGFR依赖途径为主要的耐药机制,10%~26%出现了C797S等EGFR三次突变,比例高于一线应用;部分患者T790M突变依旧保留,而43%的患者出现了T790M丢失,T790M丢失可能更容易出现旁路活化的耐药机制。

图1 EGFR-TKI耐药机制
EGFR-TKI耐药与免疫微环境针对免疫检查点的阻断治疗在驱动基因野生型晚期NSCLC治疗中取得了突破性进展,免疫治疗正逐渐成为继化疗、靶向治疗之后最有潜力的肿瘤内科治疗方法。临床证据表明小部分EGFR基因突变的肺腺癌患者能够从免疫治疗中获益,而肿瘤免疫微环境是影响免疫治疗疗效的重要因素。
近期广东省人民医院、南方医科大学的周清教授的研究团队通过单细胞转录组测序、多色免疫组化等技术,深入探讨了EGFR突变肺腺癌患者肿瘤微环境的特征。他们通过干扰素α/γ反应和PI3K-AKT-mTOR相关信号通路差异丰度测序分析发现EGFR阴性肿瘤细胞可能比突变的肿瘤细胞更能促进CD8+T细胞的增殖和功能,单细胞转录组测序的结果也显示EGFR阳性肺腺癌的T细胞中CD8+TRM细胞缺失,CXCL13表达降低,免疫抑制因子表达升高,提示EGFR突变对肿瘤微环境有负向修饰作用。实验结果显示促炎细胞的缺失、抑制型细胞类型的富集和免疫检查点蛋白的低表达可能导致EGFR突变肺腺癌具有免疫沉默环境,即EGFR突变的肿瘤细胞可以通过分泌细胞因子来招募各种免疫抑制细胞,而活化的免疫细胞则严重不足。
与此同时,也已有研究逐步发现EGFR-TKI具有影响肿瘤微环境的潜力。EGFR-TKI耐药与“炎症型”免疫微环境有关,耐药患者或能从免疫治疗中获益。2013年Akbay及其同事研究发现,胞内的EGFR信号可通过诱导T细胞凋亡和促进免疫逃逸直接或间接上调EGFR突变NSCLC中的肿瘤细胞中PD-L1的表达。近期研究证实PI3K、AKT和mTOR的下调具有降低PD-L1表达的潜力,这表明EGFR突变可能通过激活PI3K/AKT/mTOR信号通路参与调节PD-L1表达。
NF-κB及STAT3皆是EGFR激活的重要下游通路,也有研究被发现直接或间接的调节PD-L1的转录,进而通过IL-6的机制上调PD-L1的表达。这些研究结果都为免疫检查点抑制剂在靶向治疗疗效不佳且PD-L1表达上调的NSCLC中的应用提供理论依据,具体的分子机制仍需要进一步研究。
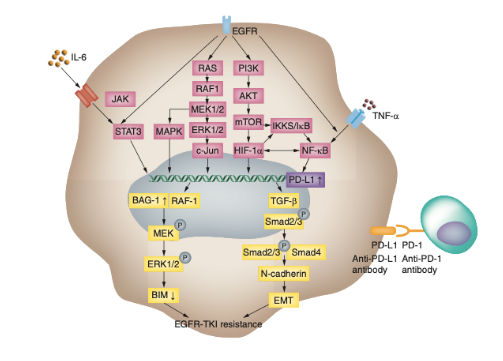
图2 EGFR调节PD-L1的表达
EGFR-TKI耐药人群免疫治疗现状
免疫治疗在EGFR-TKI耐药后NSCLC患者中的疗效争议不断。几种针对PD-1的免疫检查点抑制剂(ICI)已获得美国食品和药品管理局(FDA)的授权,用于晚期NSCLC的临床治疗,包括nivolumab和pembrolizumab。然而PD-1/PD-L1单药治疗仅在约20%的未经选择的NSCLC患者中有效,结果令人失望。继而研究者主张基于免疫治疗的联合疗法可能是一种选择。一项特瑞普利单抗联合培美曲塞和卡铂的Ⅱ期研究(CT18,NCT03513666)显示出良好的疗效。纳入EGFR突变患者的IMpower150研究表明,与化疗加抗血管生成药物相比,ICIs联合化疗和抗血管生成药物可延长患者PFS。尽管如此,这两项临床研究也显示出更高比例的3-5级不良事件。
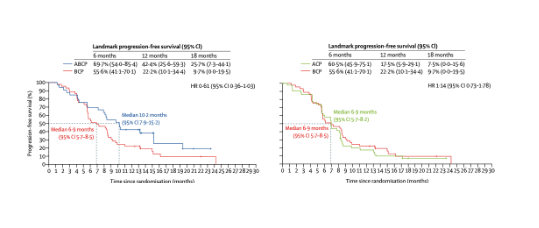
图3 IMpower150中EGFR突变患者的无进展生存期对比
ORIENT-31作为近期一项随机、双盲、3期研究,在有或没有IBI305(贝伐珠单抗生物仿制药)加化疗的EGFR突变非鳞NSCLC患者中进行免疫治疗(NCT03802240)。已于2021年11月召开的ESMO Asia Virtual Oncology Week 年会公布了中期数据分析结果。到第一次中期分析的数据截止日期(2021年7月31日,中位随访时间为9.8个月),444名患者被随机分组(A/B/C组148/145/151)。中位年龄为57岁。IRRC的中位PFS(95%CI)在A组中为6.9个月(6.0,9.3),在B组中为5.6个月(4.7,6.9),在C组中为4.3个月(4.1,5.4)。与对照组C相比A组中的PFS显著延长(HR=0.464,95%CI:0.337-0.639;p<0.0001)。B组与C组相比显示出PFS获益趋势(HR=0.750,95%CI:0.555-1.013;p=0.0584)。A与B的无效分析没有跨越无效边界(HR=0.726,95%CI:0.528-0.998)。确认的ORR在A、B和C组中分别为43.9%、33.1%和25.2%。≥3级治疗出现的AE发生率分别为54.7%、39.3%和51.0%。与单独化疗相比,信迪利单抗联合IBI305和化疗显着提高了PFS。
综上,研究结果发现,对于EGFR突变患者,四药联合免疫方案是可以考虑的治疗方案。
杜瀛瀛教授总结
针对EGFR信号通路的EGFR-TKI为EGFR突变人群带来了良好的生存获益,但大多数人在治疗后一年左右不可避免地会产生耐药性。目前缺乏可用的治疗选择。因此,研究创新策略迫在眉睫。免疫治疗作为肿瘤内科治疗的手段之一,目前尚缺乏对EGFR-TKI耐药的NSCLC患者进行免疫治疗的临床经验,并且不同临床试验的结果存在争议。不同亚型的EGFR突变、不同的给药顺序、时间和剂量都有可能影响免疫治疗的疗效,严格的选择高标准的人群将有利于改善免疫治疗的结果。鉴于免疫治疗在EGFR-TKI耐药人群中的潜在优势,了解NSCLC中肿瘤免疫介导的治疗相关生物标志物与肿瘤驱动因素之间的相关性至关重要。如何筛选免疫治疗的优势人群将是未来需要不断思考的课题。
发表评论
最新评论


