了解替加环素耐药机制 促进规范用药
本文作者:解放军总医院第一医学中心检验科 张樱 王钰

分子组组长 张樱
肺炎克雷伯菌(Klebsiella pneumoniae,KPN)是医院感染的重要致病菌之一。近年来,肺炎克雷伯菌引起的医院感染率逐年增高,且多耐药菌株的不断增加常导致临床抗菌药物治疗的失败和病程迁延,特别是碳青霉烯类耐药肺炎克雷伯菌出现给临床治疗带来了很大困难。替加环素作为新兴的四环素类药物,通过可逆结合细菌核糖体30S亚基,阻断tRNA进入核糖体A位点来抑制蛋白质的合成,达到抗菌目的,是治疗多重耐药肺炎克雷伯菌感染仅剩的有效选择之一[1]。然而,临床不断发现替加环素耐药肺炎克雷伯菌,严重限制了替加环素的临床使用。
目前已知的替加环素耐药机制主要有主动外排泵转运系统、核糖体蛋白结合位点突变、细胞膜变异、修饰酶降解等。
一、主动外排泵转运系统
1.AcrAB‐TolC外排泵
耐药结节化细胞分化家族(resistance nodulation-cell division superfamily ,RND)外排泵的过表达是介导替加环素耐药的重要原因之一。RND型外排泵主要存在于革兰氏阴性菌中,一般由3个部分组成,即内膜转运蛋白、膜融合蛋白和外膜通道蛋白[2],底物与内膜转运蛋白结合后,在膜融合蛋白的帮助下,由外膜通道蛋白排出细胞外。AcrAB-TolC外排泵和OqxAB外排泵是肠杆菌科细菌中主要的RND型外排泵。AcrAB-TolC外排泵由内膜转运蛋白AcrB、膜融合蛋白AcrA和外膜通道蛋白TolC组成。MarA蛋白、SoxA蛋白和RamA蛋白是acrAB基因的正调控因子,可上调acrAB基因的表达导致细菌对替加环素的敏感性降低[3-5]。负调控因子包括AcrR蛋白、MarR蛋白、SoxR蛋白、RamR蛋白和Lon蛋白,其中AcrR蛋白直接抑制acrAB基因的表达,MarR蛋白、SoxR蛋白、RamR蛋白和Lon蛋白则分别通过抑制正调控因子MarA蛋白和RamA蛋白的表达进而抑制acrAB的表达[6-8]。AcrAB-TolC过表达可导致替加环素MIC不超过8 mg/L。
2.OqxAB外排泵
OqxAB外排泵由膜融合蛋白OqxA和内膜转运蛋白OqxB组成,是RND家族中质粒介导的多药外排泵。目前证明oqxAB是OqxAB外排泵系统中起主要作用的保守基因,且携带oqxAB基因的质粒容易在不同种属的细菌间水平传播。rarA基因过表达上调oqxAB外排泵,可引起低水平替加环素、喹噁啉类、喹诺酮类、氯霉素等多药耐药。AcrAB-TolC和OqxAB同时过表达,替加环素MIC≥16 mg/L。
3.KpgABC外排泵
KpgABC外排泵是一种新型的RND家族外排泵。Nielse L E等在肺炎克雷伯菌的外排泵操纵子上游发现了1个IS5插入序列引起外排泵KpgABC表达上调,随后将其导入至缺失kpgABC基因的菌株中,药敏试验结果显示,替加环素MIC值上升4倍[9]。同时证实,即使没有AcrAB-TolC外排泵的参与,单独的KpgABC外排系统也可导致肺炎克雷伯菌对替加环素的耐药水平大幅度升高。
4.TMexCD1-TOprJ1外排泵
TMexCD1-TOprJ1外排泵是最近发现的由质粒介导的新的RND家族外排泵。刘建华教授团队发现TMexCD1-TOprJ1在肺炎克雷伯菌和沙门菌中的表达导致替加环素高水平耐药(MIC 16 mg/L)。TMexCD1-TOprJ1的表达可抑制沙门菌的生长,但不抑制肺炎克雷伯菌的生长,同时在肺炎克雷伯菌体内感染模型中表明替加环素治疗失败[10]。
5.MFS型外排泵
Tet(A)蛋白为最常见的主要易化子超家族(MFS)外排泵,主要介导病原体对四环素类抗菌药物耐药。一些Tet(A)突变体能够介导细菌对替加环素低水平耐药(MIC≤4mg/L)。Tet(A)突变体位于质粒上的转座子Tn1721中,这种可水平转移的基因元件对Tet(A)突变体的快速传播起到重要作用[11]。
二、核糖体蛋白结合位点突变
替加环素作用机制是通过可逆地结合细菌30S核糖体16S rRNA,阻断tRNA进入A位点,终止氨基酸进入肽链,抑制翻译过程,阻止蛋白合成,最终细菌繁殖受到抑制。由rpsJ基因编码的S10蛋白是30S核糖体的组成部分,位于替加环素与结合位点的附近。该基因突变可能会改变替加环素结合位点附近的核糖体结构或干扰Mg2+的配位,导致替加环素与16S rRNA的结合较弱,从而引起耐药[12]。相比较于非特异性的依赖于细菌种类的主动外排泵耐药机制,rpsJ基因缺失突变不依赖于细菌种类,具有高度特异性耐药,是多种细菌对替加环素耐药的靶点[13]。
三、细胞膜通透性改变
细菌细胞膜由糖脂,磷脂和蛋白质构成。PlsC是催化合成磷脂的重要酶之一,同时也是一种跨膜蛋白,参与细胞渗透性功能。plsC基因突变可导致细菌细胞膜通透性改变,降低细菌对替加环素的敏感性[14]。细菌膜上存在的膜孔蛋白是影响物质和抗生素进入细菌的主要途径,当细菌处于恶劣环境下时,膜孔蛋白基因发生突变,导致膜孔蛋白结构发生改变或者膜孔蛋白表达数量减少,改变细胞的通透性,从而导致细菌耐药。但是在大多数情况下,耐药菌株并不是单一的膜孔蛋白变异,一般与其他耐药机制共同存在。
四、修饰酶产生
Tet(x)是一种质粒产生的单氧化酶,在有氧和NADPH条件下对四环素进行化学修饰,可促使临床使用的四环素类抗菌药物包括替加环素失效。通过X光衍射射线晶体学技术,表明替加环素是tet(x)的底物[15]。tet(X1)和tet(X2)最早发现于厌氧拟杆菌和类香味菌等环境细菌,它们对四环素类抗生素的高效降解作用依赖于黄素腺嘌呤二核苷酸(flavin adenosine dinucleotide,FAD),但对替加环素仅呈现低水平耐药(≤4 mg/L)[16-18]。2019年从动物、食品和人源肠杆菌科细菌和不动杆菌中发现了新型可转移的tet(X)变异体tet(X3)和tet(X4),其与tet(X2)的同源性>85%,可介导对替加环素的高水平耐药,这是首次发现可发生水平转移的高水平替加环素耐药基因。可水平转移的高水平替加环素耐药基因的出现导致替加环素类药物耐药性发展的更为迅猛,严重威胁人类健康。目前,tet(X3)和tet(X4)在中国不同地区不同来源的不同菌种中均有检出,尤其流行于畜牧养殖业,这提醒我们要严格监控畜牧养殖业中四环素类抗生素的合理使用。

发表评论
最新评论

-
04-292025
人工智能诊疗将走向前台——医生做好准备了吗
-
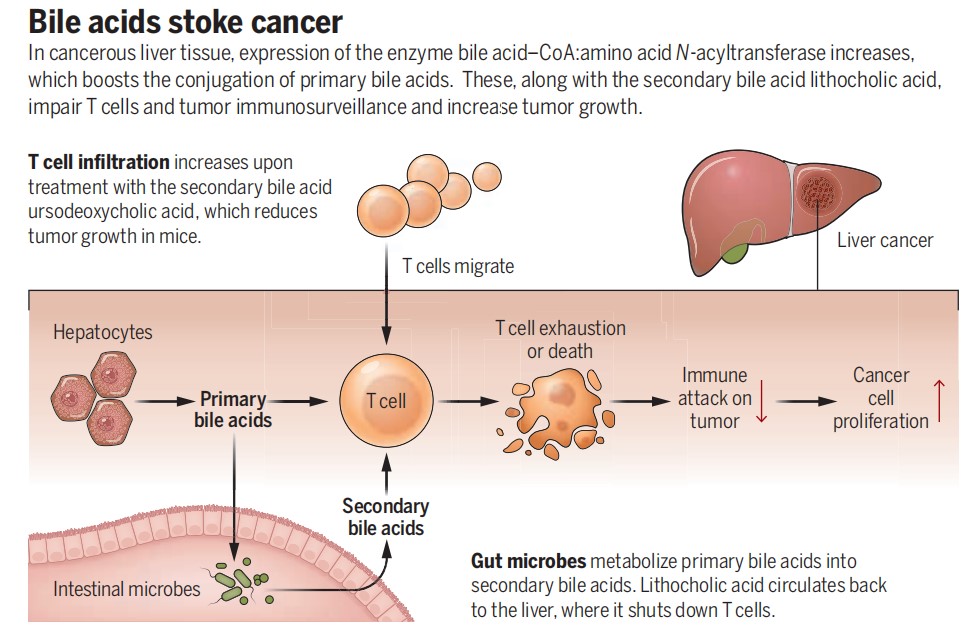
new肝癌免疫治疗的“路障”:胆汁酸 | 科普时光
2025-03-07 -
02-172025
慢病管理药先行 临床药师如何打通最后一公里
-

new双镜合壁 助力消化疾病微创精准治疗
在精准治疗、功能保护越来越多地被重视的情况下,内镜与腹腔镜“双镜联合”成为胃肠疾病诊疗的一种趋势。
2024-12-24
-

双镜合壁 助力消化疾病微创精准治疗
2024-12-24 -

朱玉龙:严重肺间质纤维化患者肺部结节经皮穿刺活检的注意事项
2024-11-21 -

IDSC感染专栏54③|重症感染患者弥散性血管内凝血早期诊断:中国诊断积分系统CDSS显优势
2022-06-28 -
IDSC感染专栏54②|夏秋季的烦恼,这种介于细菌与病毒间的病原在我国有抬头之势
2022-06-28 -
IDSC感染专栏54①|二代测序预测革兰阳性球菌耐药性有新发现
2022-06-28
-

何为巴林特小组?一文读懂
2017-02-23 -

IDSC感染专栏54③|重症感染患者弥散性血管内凝血早期诊断:中国诊断积分系统CDSS显优势
2022-06-28 -
益生菌预防艰难梭菌感染真的有效吗?
2021-09-07 -
孩子不是大人“缩微版” 小儿妇科聚焦未成年女性健康
2023-05-30 -
赵进喜教授:发挥中医药防治糖尿病肾脏病的特有优势
2023-06-09 -

倪晓光:用好手中喉镜 提升鼻咽喉早癌检出率
2023-03-07 -

心血管代谢医学|将临床研究融入社区日常临床诊疗以提高医学服务水平和质量
2021-11-05






