礼赞建党百年 守护人民健康|叶芃教授:排兵布阵食管癌手术“前、中、后”解“耗时长、并发症多、死亡率高”魔咒

食管癌是一种常见的恶性肿瘤,在我国癌症发病率和死亡率中都居于前五,严重威胁人民健康。手术切除是早期和局部进展期食管癌最有效的治疗手段。但食管癌切除手术时间长、难度大、并发症多,如何减小手术创伤、降低术后并发症的发生率和死亡率、提高患者术后生活质量和延长患者生存时间是食管外科领域的重要议题。本期《医师报》邀请到了浙江大学医学院附属第一医院的叶芃教授,分享食管癌外科技术及治疗经验。
食管癌手术三大“荆棘”:耗时长、并发症多、死亡率高
食道肿瘤位于后纵隔,前有心脏、支气管,侧有胸主动脉,位置深且复杂[1](图1),手术需切除部分食道(图2),与胃吻合方式根据癌变部位确定,一般有颈部吻合、胸膜顶吻合、弓上吻合、弓下吻合[2]。食管癌通过淋巴结向上可转移至颈部、胸部淋巴结,向下可转移至腹部,如需进行胸、腹、颈三区域淋巴结清扫,需较长时间。
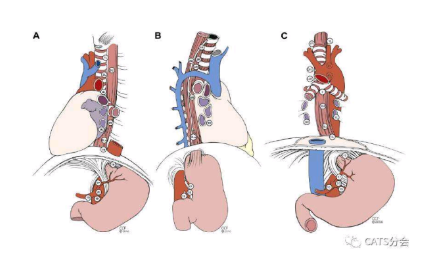
图1 食管解剖位置
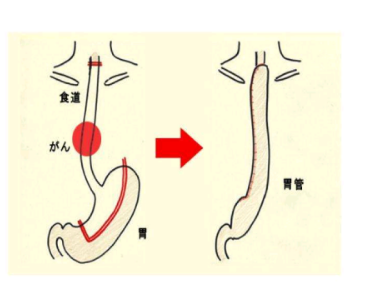
图2 食管癌手术示意图
食管癌术后并发症多,总发生率高达30%-40%,其中吻合口瘘的发生率为8.6%-10%,颈部吻合口瘘的发生率可达10%-30%;肺炎发生率为3.4%以上,急性呼吸窘迫综合症(ARDS)也时有发生。术后并发症导致的死亡率甚至可超过心脏手术死亡率。目前,食管癌微创手术最丰富的学者之一James D.Luketich教授,作为国际公认的食管癌手术高手和食管癌微创手术开拓者,其5000例微创食管癌手术的总死亡率为4%,而欧洲地区,如瑞士统计了全国五年的食管癌手术死亡率可高达6.8%。
食管癌手术风险较高,对外科医生挑战大。手术复杂、耗时长、并发症多、死亡率高是目前亟需突破的治疗难点[3],为控制这些问题,临床做出了多方面的努力和改良。
“披荆斩棘”利刃之术前MDT讨论制定最佳诊治方案
临床上遇到的大多数是中晚期食管癌患者。通过健康体检发现的早期食管癌不多,所以大多数需新辅助治疗后再手术治疗,以提高手术切除率和疗效。本中心经验是,每位食管癌患者均需完善食管CT增强扫描、超声胃镜、PET/CT或PET/MR等检查,还要进行心、脑、肺、肝、肾功能、血管等各脏器(情况)全面检查,之后邀请放射科,PET中心,肿瘤内科,放疗科,病理科,消化内科等相关专业专家进行多学科讨论,确定临床分期,个体化制定最佳治疗方案或建议参加临床研究,以求获得最佳疗效。
另外,大多数食管癌患者有嗜烟酒等不良生活习惯,很多患者合并糖尿病、高血压、冠心病、慢性阻塞性肺病(COPD)等。为增加手术安全性,需针对患者合并症情况进行预处理,做到最佳术前准备。如嗜酒患者往往维生素B1缺乏,戒酒后很多患者会出现戒断症状,这时候手术,术后并发症会很严重,死亡率增加。还有很多患者就诊时已不能正常饮食,严重营养不良,需首先建立营养通路,纠正营养不良后再进行抗肿瘤治疗。对一些合并COPD的患者,应严格进行呼吸道准备和肺功能康复训练,这样做也可明显减少术后肺部并发症。贫血患者术前应尽早补充铁剂。
总之,严密细致的治疗前准备是非常重要的,为此,我们结合自己医院及国内外其他医院的经验编写了“食管手术健康教育手册”,指导患者和医护人员积极配合,做好术前术后的各个细节。
“披荆斩棘”利刃之手术方案与技术改良
手术是降低术后并发症及术后死亡率的关键。经过多年摸索,我们对手术方案、技术进行了系列改良[4]。在既往的微创食管癌胸部手术中,食管游离或解剖时不离断,造成食管和周围结构暴露欠佳;改良后,在远离肿瘤的部位先离断食管,这样可以自由牵拉食管断端,使食管暴露更好,解剖更加清晰、安全。
既往传统的腹腔镜胃部游离顺序为大网膜-胃大弯-脾门-贲门,贲门和胃左动脉与后腹膜是固定的,显露视野时的牵拉可损伤胃短血管和脾脏,造成大出血,导致腹腔镜手术失败转开放手术,甚者需加做脾脏切除;改良后则先清扫胃左动脉和腹腔干旁淋巴结,离断胃左血管,后经食管裂孔将已离断食管牵拉至腹腔,按膈肌裂孔-贲门-脾门的顺序逆向游离,胃短血管和脾脏得到良好显露且避免损伤出血,不但大大缩短了手术时间,也增加了手术安全性,是一个很有效的改良方案,我们称之为“逆向胃游离法”。既往需至少半小时甚至一小时以上的腹腔镜手术,改良后一般只需要10-20分钟即可完成。
食管癌术后吻合口瘘是主要和严重的并发症,虽然其发生与多种因素有关,但是与外科手术的关系仍是最大的。如我们在行lvor-lewis手术时,尽可能保留足够长的带蒂大网膜,在食管吻合完成后再用大网膜包绕,由于大网膜良好的抗感染功能和炎性趋化作用,使吻合口瘘发生率大大降低,即使发生了吻合口瘘也不会造成胸腔严重感染。该方法已被国际多个临床试验证明。本中心近十年来自从使用此方法,就未再遇到因胸内吻合口瘘而死亡的病例(图3)。另外,在颈部吻合时使用分层手工吻合,或使用圆形吻合器吻合后加固缝合的措施显著降低了吻合口瘘的发生率。
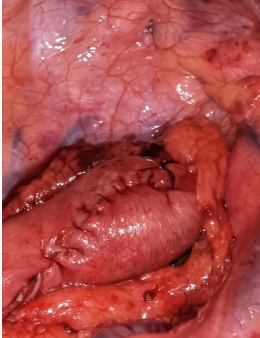
图3 改良后lvor-lewis手术胸部吻合技术
“披荆斩棘”利刃之严防术后并发症
食管癌术后各种并发症发生率可达40%左右,严重并发症有吻合口瘘、管胃坏死、ARDS、术后胸腔腹腔出血、乳糜胸、吸入性肺炎、肺动脉栓塞、心律失常等。积极预防并及时发现和正确处理这些并发症才能减少其发生率,提高治愈率。除术后常规的严密观察治疗外,我们对每一个患者都在术后第一天开始就使用肠内营养,术后5天增加到达标量,可维持术后良好的营养状况。
术后ARDS和肺部感染,肺不张是最常见的危险并发症,及时检查胸部CT可以发现,我们常规在术后第一天或第二天检查一次胸部CT,使这些并发症能早期发现并得到及时处理,大大降低了术后死亡率。术后早期常规安排胸部CT,可早期发现ARDS、肺不张、胸腔积液等问题,及早予体位排痰、物理引流、支气管镜吸痰等处理,可明显降低肺部感染,呼吸衰竭等严重并发症的发生。
中性粒细胞减少症作为化疗最主要不良事件,防治不及时可加重患者术后感染、增加手术死亡风险[6][7];术后应密切监测患者血液学指标情况,术前接受放化疗、辅助治疗患者参照化疗相关中性粒细胞减少二级预防原则,对中性粒细胞减少症及FN进行合理防治。
“披荆斩棘”利刃之食管癌机器人手术
自达芬奇机器人诞生以来,机器人手术在外科逐渐被推广[8]。机器人手术在胸外科食管癌等病种中显露明显优势,第四代四臂达芬奇机器人(图4)右侧两臂可辅助显露三维立体结构、放大视野,组织结构非常清晰,且其机械臂可360度灵活转动,解剖和淋巴结清扫比人工普通腔镜更精细、更彻底[9][10]。近几年达芬奇机器人在食管癌领域使用渐多,国际上多项研究[4][11][12]已证明机器人微创食管癌手术术后并发症情况、生活质量优于普通腔镜手术。
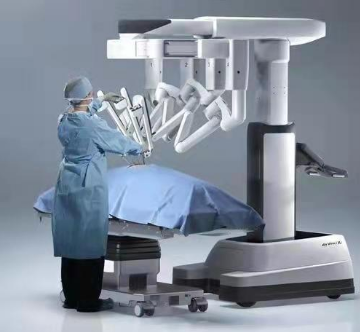
图4 第四代达芬奇机器人
叶芃教授总结
针对食管癌手术耗时长、术后并发症多、死亡率高等问题,我科进行了临床多方面的努力和术式改良。通过加强围术期管理,术前MDT制定规范治疗方案、术式及方案改良等多方面控制,手术耗时明显缩短,术后并发症发生率、手术死亡率明显降低。我个人近两年完成的200多台手术中仅出现一例死亡,科内手术死亡率为0.5%-1%,处于较低水平。我院食管癌机器人手术自2020年8月开展至今,已积累了50多例经验,为今后这方面的继续探索打下基础。此外,多项食管癌相关临床研究正在开展中,为进一步探索提高食管癌综合治疗效果,提高生存率作出贡献。
参考文献:
1.韩红战.食管癌的解剖与治疗策略[J].中国医药指南,2012,10(29):461-462.
2.何晓峰,成强,喻傲,等.食管癌微创手术下胃食管吻合方式的应用进展[J].中华胸部外科电子杂志,2022,9(01):41-45.
3.邓汉宇,王志强,陈龙奇.食管癌手术的热点研究进展[J].中国胸心血管外科临床杂志,2017,24(03):233-238.
4.Anderegg MC, Gisbertz SS, van Berge Henegouwen MI. Minimally invasive surgery for oesophageal cancer. Best Pract Res Clin Gastroenterol, 2014, 28(1): 41-52.
5.Boone J, Livestro DP, Elias SG, et al. International survey on esophageal cancer: part I surgical techniques. Dis Esophagus, 2009, 22(3): 195-202.
6.秦叔逵,马军.中国临床肿瘤学会(CSCO)肿瘤放化疗相关中性粒细胞减少症规范化管理指南(2021)[J].临床肿瘤学杂志,2021,26(07):638-648.
7.Pathak R, Giri S, Aryal MR, et al. Mortality, length of stay, and health care costs of febrile neutropenia-related hospitalizations among patients with breast cancer in the United States. Support Care Cancer. 2015 Mar;23(3):615-7.
8.Clark J, Sodergren MH, Purkayastha S, et al. The role of robotic assisted laparoscopy for oesophagogastric oncological resection; an appraisal of the literature. Dis Esophagus, 2011, 24(4): 240-250.
9.Kernstine KH, DeArmond DT, Karimi M, et al. The robotic, 2- stage, 3-field esophagolymphadenectomy. J Thorac Cardiovasc Surg, 2004, 127(6): 1847-1849.
10.Lanfranco AR, Castellanos AE, Desai JP, et al. Robotic surgery: a current perspective. Ann Surg, 2004, 239(1): 14-21.
11.Biere SS, van Berge Henegouwen MI, Maas KW, et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomised controlled trial. Lancet, 2012, 379(9829): 1887-1892.
12.Maas KW, Cuesta MA, van BergeHenegouwenMI, et al. Quality of life and late complications after minimally invasive compared to open esophagectomy: Results of a randomized trial. World J Surg, 2015, 39(8): 1986-1993.
13.Martin Rutega˚rd, MD, PhD1 , Pernilla Lagergren, RN, PhD1 , Ioannis Rouvelas, MD, PhD1 ,Intrathoracic Anastomotic Leakage and Mortality After Esophageal Cancer Resection: A Population-Based Study.Ann Surg Oncol (2012) 19:99–103 DOI 10.1245/s10434-011-1926-6.
发表评论
最新评论


