FDA:医疗活动中禁用有粉手套
有粉手套可致呼吸道炎症、过敏反应、肉芽肿和腹膜粘连等
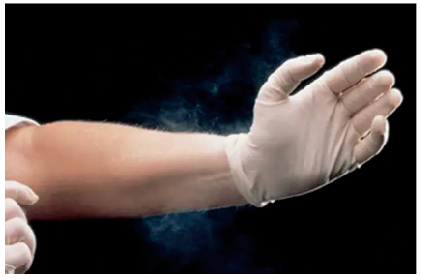
近日,美国食品药品监督管理局(FDA)最终决定医疗活动中禁用有粉手套,包括外科手套,检查手套和用于润滑可吸收粉未的外科手套。因为有粉手套会对人体造成伤害。(FDA官网)
早在今年3月,FDA就提出了禁止有粉手套的提案,如今公众评议期满,此项禁令开始生效。FDA在其声明中表示,有粉手套(无论何种类型)已证实与诸多潜在危害有关,包括严重的呼吸道炎症、过敏反应(包括哮喘)、超敏反应、肺炎和肺组织损伤、肉芽肿和腹膜粘连。吸入手套中的粉未蛋白质可引起呼吸过敏反应。
长期的临床试验研究表明,带粉的人造橡胶手套虽然不存在过敏反应风险,但是粉末与皮肤接触,在湿润的环境下会反复刺激手部皮肤,从而引起一系列炎性刺激反应。医用手套中的粉末可能导致呼吸道过敏反应,与广泛潜在的严重不良事件相关,包括严重呼吸道炎症、伤口炎症及术后粘连等。
这些不良反应归因于各种手套所使用的手套粉。通常医院会在有粉手套使用前用无菌水进行表面冲洗,但研究表明,反复冲洗并不能完全带走手套上的淀粉残留。
FDA称无粉手套包括外科使用和检查使用的手套同样可以对患者和医务人员提供和有粉手套一样的保护作用,但并不会造成任何风险。
医用手套发明的缘由并非为了避免感染,涂上粉末是为了方便佩戴手套。手术手套用粉最早为石松子及滑石粉或二者的混合物,但在上世纪 40 年代时,滑石粉导致的肉芽肿病例陆续出现,目前已基本停用。1947年开始用植物淀粉作为手套润滑剂,并一直沿用至今。
“白求恩·康盛脊柱畸形矫正爱心
捐助公益项目”在京启动
本报讯(记者 裘佳)12月22日, 由白求恩公益基金会与山东康盛医疗器械有限公司在国际骨科与创伤学会(SICOT)中国部的协调下共同发起设立,为救助贫困脊柱侧弯患者的“爱的支撑-白求恩·康盛脊柱畸形矫正爱心捐助公益项目”在京启动。该项目将在未来3年为100个需侧弯矫形手术的脊柱畸形患者免费提供手术置入物。
据悉,该项目将在北京、内蒙古、辽宁、黑龙江、吉林、陕西、甘肃、湖北、江西、浙江、山西、河南、河北、山东、贵州、四川、重庆、福建、广东等地的50多家医院作为定点医院。经定点医院的专科医生确诊适宜手术,并符合救助标准患者,将在上述定点医院接受脊柱矫形手术。项目将重点向城乡低保、经济支付能力差的贫困家庭倾斜。
早期静注维生素和糖皮质激素
或降低脓毒症死亡率
全球每年约有1500~1900万例脓毒症患者,在低收入国家的死亡率接近60%。美国一项研究显示,早期静脉注射维生素C、糖皮质激素和维生素B1,或可有效预防包括急性肾损伤在内的进行性器官功能障碍,降低严重脓毒症和感染性休克患者的死亡率。(Chest.12月 6日在线版)
研究纳入94例入住连续入住ICU的脓毒症患者,47例接受静脉注射氢化可的松、维生素C、维生素B1治疗7个月(治疗组),治疗组和对照组的基线特征无显著差异。
结果显示,治疗组医院病死率为8.5%(4/47),对照组为40.4%(19/47)。所有治疗组患者的SOFA评分均下降,并且无一例患者出现进展性器官衰竭。
治疗组所有患者升压药使用也逐渐停用,在维生素C治疗方案开始后停用升压药的平均时间为18.3 h,而在对照组升压药使用的平均时间为54.9 h(P<0.001)。
警惕减肥手术后胃肠道问题
腹腔镜胃旁路术是治疗肥胖症的有效方法,但新西兰一项研究发现,接受该手术的患者常在手术2年后自述存在胃肠道问题,包括消化不良和食物不耐受。(Brit J Surg.12月19日在线版)
该研究纳入249例接受减肥手术的肥胖患者和295例肥胖对照组,他们都完成了一项问卷调查。
结果显示,70.7%的手术治疗组患者术后对特定的食物不耐受,尤其是对高脂肪或高糖含量的食物以及红肉等。而肥胖对照组的该比例仅为16.9%。
研究者表示:“大多数减肥手术往往注重手术后的短期效应,而关于胃旁路手术对胃肠道疾病长期影响的了解十分有限。该研究结果提示,医护人员应对其患者在手术前后提供更好的健康咨询。也提醒患者在考虑进行胃旁路手术前需要深思熟虑。”

复方丹参滴丸FDA国际多中心Ⅲ期临床试验成功
12月23日,上海证券交易所官网发布《天士力制药集团股份有限公司关于复方丹参滴丸美国FDA国际多中心Ⅲ期临床试验结果的公告》。
公告称,天士力制药集团股份有限公司独家产品复方丹参滴丸为申报FDA在美国新药上市批准,进行了全球多中心随机双盲大样本Ⅲ期临床试验,经过一系列数据管理和统计分析,形成了《临床试验顶层分析总结报告》。
根据该报告,复方丹参滴丸治疗慢性稳定性心绞痛的FDAⅡ期临床试验的安全性、有效性得到了进一步验证。
临床试验结果显示:复方丹参滴丸组可显著增加稳定性心绞痛患者最大运动耐受时间(TED),其作用显著优于安慰剂对照组和三七冰片拆方组。复方丹参滴丸组对多种类型心电图异常的较严重稳定性心绞痛患者的疗效也显著优于安慰剂对照组及三七冰片拆方。复方丹参滴丸组对比安慰剂组可减少2周内硝酸甘油约25%的使用量,同时可显著减少2周内27%的心绞痛发作次数。
试验期间未发生任何与试验方案或复方丹参滴丸相关的严重不良事件。与FDAⅡ期临床试验的安全性结果一致,再次证明了复方丹参滴丸的临床安全性。
该项研究是天士力制药集团股份公司为申报FDA在美国新药上市批准所进行的复方丹参滴丸(T89)治疗慢性稳定性心绞痛多中心、随机、双盲、大样本Ⅲ期临床试验 (T89-07-CAESA),分别在全球9个国家/地区、127个临床试验中心进行,约千名受试者和约500名研发人员参与了本试验。
复方丹参滴丸于1993年获得国家新药证书和生产批件,目前作为国家行政保护品种、国家基本药物、国家医疗保险药物和中医急救必备药物,已成为治疗冠心病心绞痛临床一线基本用药。
1998年2月,复方丹参滴丸以药品身份正式通过FDA的临床研究申请。2006年公司重新向FDA申请了新的临床研究,明确了预防和治疗慢性稳定性心绞痛的适应证。2010年FDAⅡ期临床试验顺利完成,并取得良好的试验结果。如今,复方丹参滴丸美国FDAⅢ期临床试验的成功,完善和发展了现代中药的国际化先进评价体系,必将对中药国际化发展产生巨大影响。

发表评论
最新评论

-
02-172025
八家学协会共同发布心脏置入式电子设备合理应用标准,用好心电设备 守护心律健康
-

new《妇科肿瘤免疫检查点抑制剂临床应用指南(2023版)》正式发布
2023-04-09 -
03-132023
2023年春季成人流行性感冒中医药防治专家共识
【编者按】 自 2023 年春季以来,流行性感冒发病在我国各地呈上升趋势,本病属于中医“疫病”“时行感冒”范畴,中医药在减轻、消除流感症状、缩短病程方面疗效显著,为有效防治当前春
-

newCACA技术指南精读巡讲
2023-02-13
-

CACA技术指南精读巡讲
2023-02-13 -

《晚期非小细胞肺癌抗血管生成药物治疗中国专家共识(2019版)》发布
2019-07-26 -

简单路径 打通高血压指南实施最后一公里
2019-02-21 -

全程管理 让艾滋病患者在有效治疗下长期、有质量生存
2018-12-23 -

《中国脑卒中防治报告2018》解读
2018-11-13
-
2023年春季成人流行性感冒中医药防治专家共识
2023-03-13 -

《妇科肿瘤免疫检查点抑制剂临床应用指南(2023版)》正式发布
2023-04-09 -
【指南与共识】女性慢性心力衰竭管理的中国专家共识
2022-08-02 -

CACA技术指南精读巡讲
2023-02-13 -

良性前列腺增生指南权威解读:重视全病程管理,让指南走向基层服务临床!
2022-06-25 -

重磅!9部全国肿瘤放疗质控指南在深发布(附指南下载地址)
2021-12-27 -

《中国脑卒中防治报告2018》解读
2018-11-13







