首个国产PD-L1伴随诊断产品性能表现卓越
首个国产PD-L1抗体试剂获批上市!
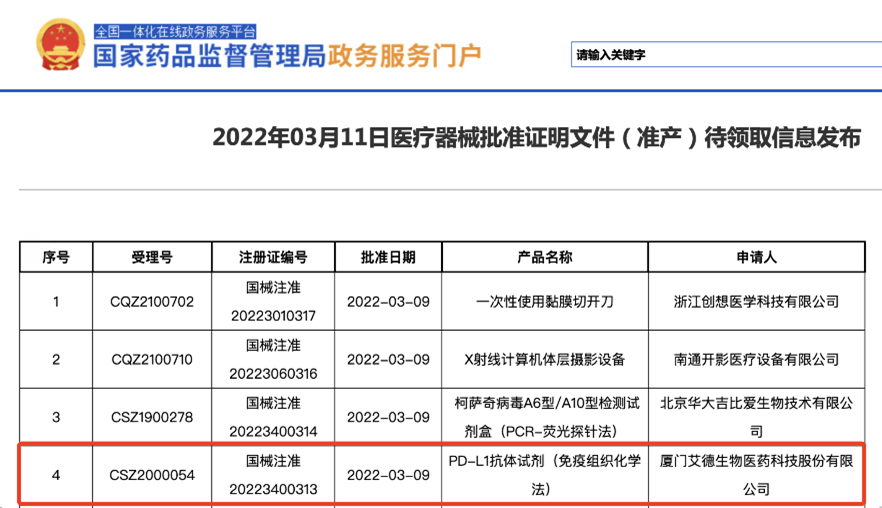
2022年3月11日,国家药品监督管理局(NMPA)发布消息,由艾德生物的 “PD-L1抗体试剂(免疫组织化学法)”正式获批上市,用于非小细胞肺癌患者帕博利珠单抗一线用药指导。此次获批的PD-L1检测试剂是免疫治疗药物“帕博利珠单抗(商品名:可瑞达/Keytruda)”的伴随诊断。该产品采用的单克隆抗体代码为E1L3N 。国际研究表明, E1L3N与22C3、28-8等主流抗体有着良好的一致性; 2017-2019年期间NordiQC发起并连续进行了5轮肺癌PD-L1检测质控, E1L3N抗体试剂的检测结果达标率100%。该产品的注册临床研究数据同样表现优异:与对照试剂22C3有非常好的一致性,总体符合率高达95.87%,且药效验证结果支持该产品可较好识别出适合帕博利珠单抗单药治疗的NSCLC患者。
目前,针对免疫检查点PD-1/PD-L1的单抗抑制治疗是肿瘤精准医疗的重要治疗策略之一,但并非所有的肿瘤患者都能从这类治疗中获益,因此,借助检测生物标志物选择适治患者是临床的刚性需求。肿瘤组织PD-L1表达水平评估是目前临床认可度最高的PD-1/PD-L1抑制剂疗效预测标志物。大量研究表明,相比PD-L1表达阴性患者,PD-L1表达阳性患者更容易从免疫治疗中获益,且肿瘤组织中PD-L1表达水平越高,患者从PD-1/PD-L1抑制剂治疗中获益的机会越大,国内外非小细胞肺癌(NSCLC)临床指南均以1A证据级别推荐患者常规进行PD-L1检测。
责任编辑:许奉彦
发表评论
最新评论

相关文章推荐
-

new凯西中国引入启尔畅®易悦达®,开启哮喘治疗新篇章
2025-09-16 -
new十年跨界深耕 智慧医疗助力健康中国 | 2025华夏互联网与高血压AI医学创新大会在京开幕
2025-09-15 -

new医者行动,引领健康风尚—2025首都国际医学大会序章活力开幕
2025-09-15 -

new整合国内外优质资源 共筑运动医学新生态
2025-09-15
推荐阅读
-

上海市儿童医院颜崇兵:日夜分护,大幅降低婴幼儿“红屁屁”发生率
2025-08-12 -
30万罚单揭开短视频合规危机
2025-07-07 -

专家来辟谣,院士齐推荐!这场健康科普大会 治好您的“体重焦虑”
2025-04-09 -

2025年医TV健康日直播计划
2025-02-10 -

成为有力的临床科室 | 拓展临床麻醉内涵,提供更多更好的医疗服务
2025-02-06
热门资讯
-

展风采 砺初心 勇担当 | 首届“中青年肿瘤防治菁英”名单公示
2023-12-26 -

国家呼吸医学中心“无管中心”正式成立!
2024-12-08 -

齐鲁医院领衔主编 《中国心脏骤停与心肺复苏报告(2022年版)》发布
2023-04-26 -

第八届医学家年会⑫ | 山东省耳鼻喉研究所所长、山东省耳鼻喉医院名誉院长王海波:30年倾情守护国人耳鼻喉健康
2023-04-11 -

第十一届海峡两岸消化论坛暨世界华人消化高峰论坛在厦门召开
2023-06-11 -
首个国产PD-L1伴随诊断产品性能表现卓越
2022-03-13 -

她是护士,也是抗美援朝战士
2023-05-11






