育见前沿 | 原研rhFSH-α较生物类似药与尿源性Gn更具成本效益

解读专家

陈智勤
背景与研究目的
不同Gn药物的来源、生产、纯化及定量方法不同,导致Gn药物间纯度、卵泡刺激素(follicle-stimulating hormone,FSH)异构体、糖基化模式、唾液酸残基组成及等电点系数均存在差异,这些差异可能影响最终助孕结局。最近发表的一项基于法国国家健康数据库(the French nationwide claims database,SNDS)的153 600例患者的研究数据显示[2],应用原研rhFSH-α较尿源性Gn与rFSH-β可改善鲜胚移植活产率与累积活产率;且据数据统计,在接受辅助生殖治疗的女性中已经有超过2 400万个周期使用了原研rhFSH-α,原研rhFSH-α已见证了预计超600万婴儿的出生[3] ,综上数据均强调了原研rhFSH-α对公共生殖健康的重要影响。那么考虑到Gn用药相关的成本,评估原研rhFSH-α与其他Gn药物的成本效益变得至关重要,有助于确保辅助生殖技术(assisted repproductive technology, ART)中的资源配置得到优化,以最优化临床结局及成本效益。本研究基于SNDS中辅助生殖治疗的真实数据,调查了不同Gn药物的成本效益。
方法
2013年1月31日至2018年12月31日期间在法国接受卵巢刺激的245 534个周期被纳入研究,根据Gn用药选择分为3组:原研rhFSH-α(默克:果纳芬®,n=110 439)、生物类似药(n=12 287)及尿源性Gn[高纯度人绝经期促性腺激素(high purity human menopausal gonadotropin, HP-hMG,辉凌, 贺美奇®;IBSA FARMACEUTICI SRL, Fertistartkit®,n=65 654)、高纯尿源性促卵泡激素(high purity urinary follicle-stimulating hormone,HP-uFSH,IBSA FARMACEUTICI SRL , Fostimonkit®,n=7 821)]。随访截止至2019年12月31日。
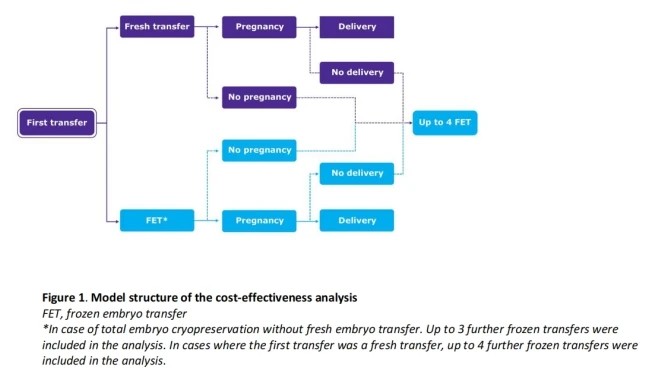
研究结果
1. 原研rhFSH-α对比生物类似药:
在仅考虑一次鲜胚移植的情况下,原研rhFSH-α较生物类似药具有更高的鲜胚移植活产率(16.7%比15.2%,差值1.5%),每活产的ICER为5 538欧元、且原研rhFSH-α较生物类似药每活产成本更低(26 010欧元比28 037欧元),如表1所示。
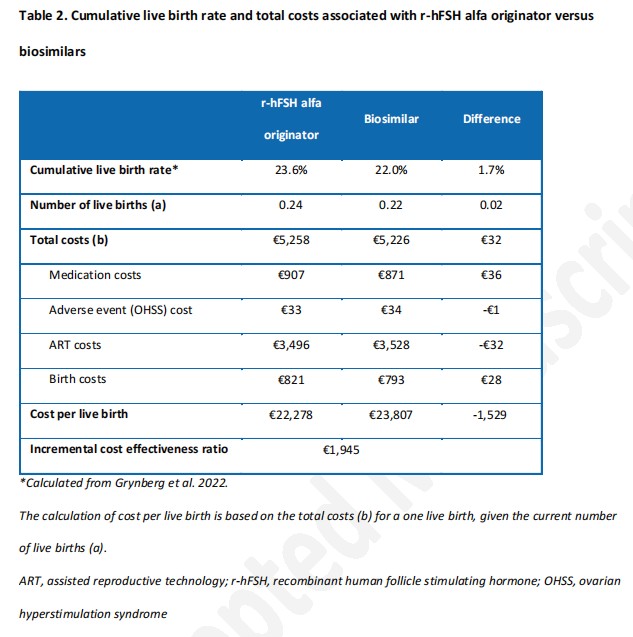
在累积周期的情况下,原研rhFSH-α较生物类似药具有更高的累积活产率(23.6% 比22.0%,差值1.7%),每累积活产的ICER为1 945欧元,且原研rhFSH-α较生物类似药每累积活产成本更低(22 278欧元比23 807欧元),如表2所示。
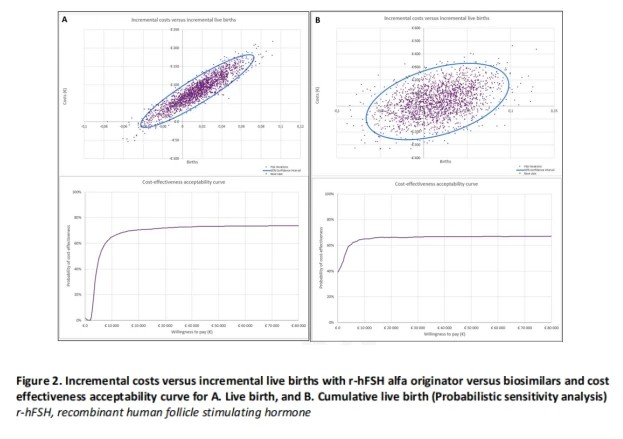
PSA一致表明,假设在每例活产婴儿20 000欧元的支付意愿条件下,原研rhFSH-α较生物类似药具有更高的成本-效益可接受性概率(图2A和2B)。成本-效益可接受性曲线显示,在假设每例活产婴儿20 000欧元的支付意愿条件下,原研rhFSH-α的成本-效益可接受性概率分别为70.5%(基于活产)、66.3%(基于累积活产)(图2A和2B)。
2. 原研rhFSH-α对比尿源性Gn:
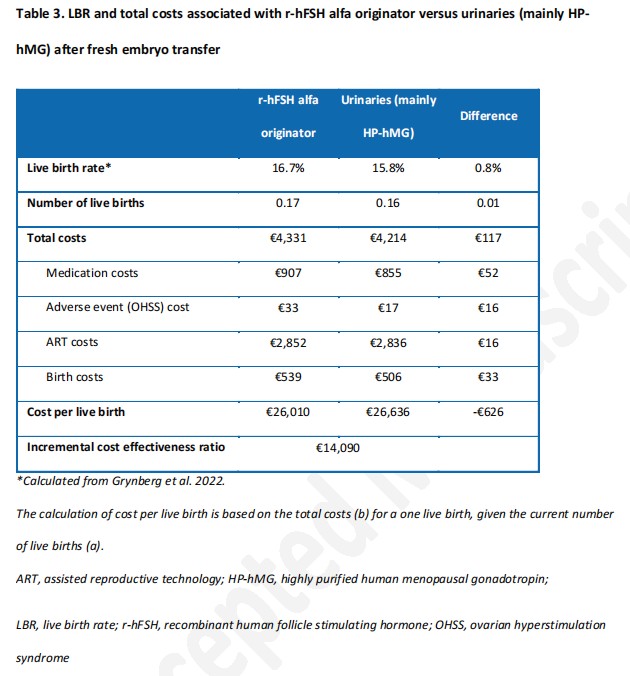
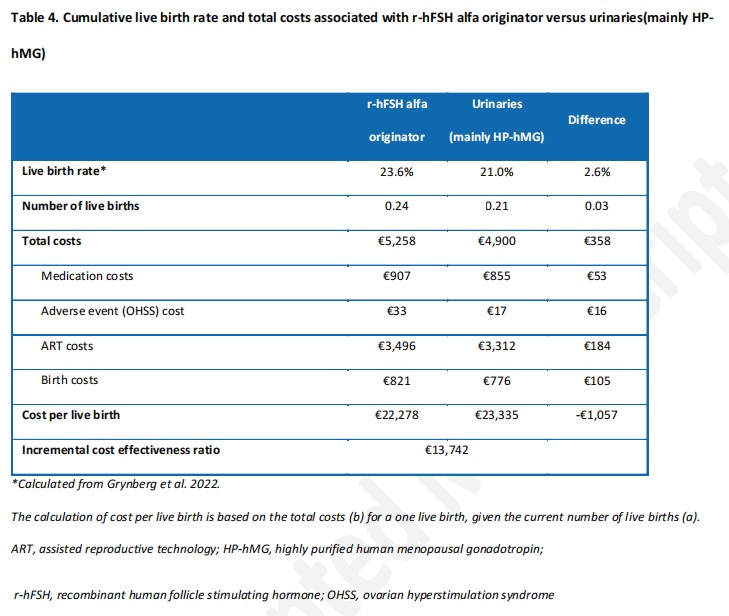
在累积周期的情况下,原研rhFSH-α较尿源性Gn具有更高的累积活产率(23.6%比21.0%),每累积活产的ICER为13 742欧元,且原研rhFSH-α较尿源性Gn每累积活产成本更低(22 278欧元比23 335欧元),如表4所示。
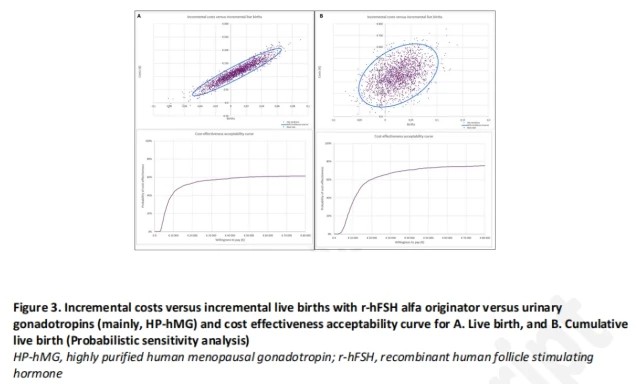
PSA一致表明,在假设每例活产婴儿20 000欧元的支付意愿条件下,原研rhFSH-α较尿源性Gn具有更高的成本-效益可接受性概率(图3A和3B)。成本效益可接受性曲线显示,在假设每例活产婴儿20 000欧元的意愿支付条件下,原研rhFSH-α的成本-效益可接受性概率分别为53.5%(基于活产)、60.5%(基于累积活产),详见图3A和3B。
结论与讨论
基于法国真实世界研究的成本效益分析数据可得,卵巢刺激中应用原研rhFSH-α较尿源性Gn与生物类似药可获得更高的鲜胚移植活产率及累积活产率,且每活产成本或每累积活产成本更低,成本效益更高。
发表评论
最新评论

-

new咳嗽里的时间差:一张HRCT改变的两种人生 | 与光同行
2025-10-11 -

new虞文魁教授、宗媛教授、尚游教授详解脓毒症破局之道,个体化精准治疗是关键!
2025-09-30 -

new吉大二院刘斌教授:解码血脂管理核心密码 助力健康中国建设|『心』中有数『脂』掌健康
2025-09-30 -

new解码补体,共话PNH诊疗新纪元——2025补体日学术大会血液分论坛圆满闭幕
2025-09-23
-

国际妇女节专题丨郭晓蕙:保护甲状腺 切忌“听风就是雨”
2024-03-05 -

第九届医学家年会(2024)
2024-01-04 -

致敬中国医师节·健康中国 你我同行 | 陈良万教授“人工心脏”团队:白塔红墙下的世纪坚守——时光不改,医者初心
2022-09-05 -

致敬中国医师节·健康中国 你我同行 | 宣武医院药学部张兰教授团队:中西药携手,筑牢安全用药底线
2022-09-05 -

敢于打破学科发展的“天花板”,上海市第十人民医院“溶取栓中心”成立
2022-08-05
-

第八届医学家年会⑨ | 吴华:迎难而上 在摩擦力中前行
2023-03-29 -

【热点】17岁女孩吸食笑气中毒,坐轮椅回国治疗……神内医生说:这个流行于酒吧等场所的东西害人不浅!
2017-07-07 -
闫慧敏教授:加强小儿胃肠道疾病防治 重视中医药应用!
2023-04-14 -

敢于打破学科发展的“天花板”,上海市第十人民医院“溶取栓中心”成立
2022-08-05 -

致敬中国医师节·健康中国 你我同行 | 陈良万教授“人工心脏”团队:白塔红墙下的世纪坚守——时光不改,医者初心
2022-09-05 -

现实版“飞越疯人院”
2017-07-28 -

致敬中国医师节·健康中国 你我同行 | 宣武医院药学部张兰教授团队:中西药携手,筑牢安全用药底线
2022-09-05






