艾伯维:“药王”只是开始 多元发展创大格局

艾伯维生物研发中心
你认识的艾伯维是什么样子的?
“药王”?当然是!但它还是丙肝治疗领域的新王者,是肿瘤领域的新大腕,是续演免疫神话的缔造者。
变的是格局,不变的是宗旨——以患者为中心,满足更多未被满足的医疗需求。为了把更好的治疗方案带给中国患者,艾伯维一直在努力着,且进行多方合作,以让更多患者享受到前沿、创新药物。
免疫领域
一路称霸的全球药王——修美乐
说起艾伯维,就会说到修美乐。
全球药王,自2012年起年年称霸单药榜首,至今无人能撼江湖地位……这些是修美乐的标签。事实上,标签背后的数据更让人动容。
修美乐目前在全球已获批17个适应证,在超过100个国家和地区服务超过100万名患者;在中国获批用于治疗类风湿关节炎、强直性脊柱炎和中重度斑块状银屑病,未来还会进军消化科、儿科和眼科等领域,治疗包括克罗恩病、儿童斑块状银屑病、幼年特发性关节炎、葡萄膜炎等疾病。
修美乐的药王之路是怎么走出来的呢?
它是基于2018年诺贝尔化学奖——“噬菌体展示”技术研发而成的创新药;
是全球首个获批上市的全人源抗肿瘤坏死因子单克隆抗体;
是2007 年有医药界诺贝尔奖之称的“盖伦奖”得主。
这样的创新药,可说是天生美玉。
修美乐的成功来自其显著的疗效、坚实的安全性数据,以及跨学科的适应证。在全球,修美乐拥有长达20年的研究数据,超过100个临床研究,覆盖超过3.3万名患者。特别值得一提的是,相比传统药物50次质检,修美乐需要超过250次独立的、严格监控的质检,以保证产品的一致性。如此繁琐的质检堪称“史上最严”。
自2002年在美国获批上市,因修美乐获益的患者以百万计,未来,这个数据还将继续走高乃至成倍计增长。随着越来越多的适应证在中国获批,“药王”如能进入医保目录,相信将有更多中国患者获益。
抗病毒领域
丙肝治疗的新贵已显王者之风
丙肝,是一个严重影响社会和公共卫生的疾病,对患者的健康和生命危害极大。作为一家拥有高度社会责任感的研究型生物制药公司,艾伯维积极投入,研发出可治愈丙肝的直接抗病毒治疗方案。
中国有约1000万的丙肝患者,其中56.8%属于基因1b型。艾伯维的维建乐联合易奇瑞方案对基因1b型丙肝有高达99.5%~100%的治愈率及良好的安全性,彰显了艾伯维不让任何一个患者成为治愈例外的决心。
更令人期待的是,艾伯维的泛基因型丙肝新药MAVIRET™有望于2019年在中国获批上市。该方案用于治疗初治、无肝硬化的慢性丙肝患者,可在8周内就实现99%的病毒治愈率,受到包括世界卫生组织指南在内多个国际权威指南的推荐。MAVIRET™在欧盟和美国均获得加速或优先审评,并分别于2017年7月和8月获批上市。
8周短疗程、高治愈率、适用于肾损伤患者等优势,让MAVIRET™迅速成为全球丙肝治疗领域的新王者。在2018年上半年的销售额已经大幅超过行业预期,销售额飙升至18亿美元以上。根据 IQVIA 数据,上市后仅 2 个季度,MAVIRET™的每周新处方数量已经超过了吉利德的 Harvoni 及 Epclusa。
在2018年美国肝病研究学会年会(AASLD)上,艾伯维公布了MAVIRET™的最新研究结果。EXPEDITION-8研究表明,基因1、2、4、5和6型的伴代偿期肝硬化的慢性丙肝初治患者经过8周治疗后,持续病毒学应答(SVR12)达到100%。这意味着,伴代偿期肝硬化的丙肝患者也有望在8周内通过使用MAVIRET™获得病毒学治愈。DORA研究表明,12~17岁丙肝患者在接受MAVIRET™治疗后,SVR12也达到了100%,安全性与成人相似。
随着艾伯维泛基因型方案—MAVIRET™即将登陆中国,更多的丙肝患者将能更快地获得治愈,回归健康生活。
未来发展
多领域并进成就大格局
免疫学、肿瘤学、抗病毒学和神经科学,是艾伯维的四大核心领域。如今,艾伯维多元发展模式已见规模。
艾伯维在肿瘤领域的进展让人惊喜。凭借自身强大的研发和积极的行业合作,目前艾伯维的肿瘤产品线包括多个已上市产品和新的分子。比如已在包括美国之内的50多个国家获批上市的VENCLEXTA®(Venetoclax片),于近期获美国FDA加速批准,与阿扎胞苷或地西他滨或低剂量阿糖胞苷(LDAC)联用治疗75岁及以上或因合并症不适合使用强诱导化疗的新确诊的急性髓系白血病(AML)患者。同时,VENCLEXTA®也在被研发用于治疗其它恶性血液肿瘤,包括慢性淋巴细胞白血病(CLL)、多发性骨髓瘤(MM)、非霍奇金淋巴瘤(NHL)和骨髓增生异常综合征(MDS)。借着中国提速创新药审批的东风,艾伯维正在积极推动这类创新的肿瘤产品进入中国,满足更多中国患者的治疗需求。未来,艾伯维在肿瘤领域的突破是相当值得期待的。
在免疫学领域,艾伯维一边延续修美乐的传奇,一边开发新的产品,以巩固其王者地位。最为引人关注的是Upadacitinib和Risankizumab。
Upadacitinib是一款在研的口服选择性JAK1抑制剂,针对包括类风湿关节炎、特应性皮炎、克罗恩病、溃疡性结肠炎、银屑病关节炎和强直性脊柱炎在内的多个免疫介导的炎症性疾病。2018年12月底,艾伯维已向美国FDA提交了新药申请,并向欧洲药品管理局(EMA)提交了上市许可申请,申请批准Upadacitinib用于治疗成人中重度类风湿关节炎(RA)患者。
业界对Upadacitinib的商业前景非常看好。2018年5月,医药市场调研机构EvaluatePharma发布报告预测,Upadacitinib在2024年的全球销售额将达到25.7亿美元,成为全球第五大畅销抗风湿药物。
Risankizumab是一款在研的白介素-23(IL-23)抑制剂。它通过与IL-23的p19亚基相结合,有选择性地阻断IL-23信号通路。IL-23是炎症过程中的一个关键细胞因子,与多种慢性免疫介导疾病相关。2018年9月,艾伯维公布了Risankizumab治疗银屑病的3项关键性临床3期研究中的积极结果。在所有三项临床研究中,患者汇报使用Risankizumab后,与健康相关的生活质量、精神健康和工作效率都获得显著改善。
艾伯维如此强大且多元化的研发线,得益于其持续的研发投入与创新能力。艾伯维67%的3/3b期临床研究被科学界认为具有首创性。据EvaluatePharma预测,到2022年,艾伯维的研发线价值将排全球第三,有4个排名前20的最具价值的研发产品。
修美乐创造的傲人成绩,使艾伯维站在了行业的高点上。这个高点,更是艾伯维发展的新起点。艾伯维四大核心领域研发产品线所显示的无限潜力,使我们有理由相信,艾伯维已经布好了未来的多元化发展大局。

官微二维码

发表评论
最新评论

-

new“5年投20亿”支持颠覆性创新,“先声全重求索计划”聚焦十大科学难题
2025-03-31 -

new专治疑难杂症——聊城市四院心身医学科知“心”更懂“身”
专治疑难杂症——市四院心身医学科知“心”更懂“身”
2024-12-29 -

new2024北京乳腺健康产业大会|聚焦乳腺产业创新,打造肿瘤慢病管理标杆
2024-04-19 -

new2024北京乳腺健康产业大会 | 乳腺健康要从单纯依靠医疗卫生系统向全社会整体联动转变
2024-04-19
-

品茶:不仅品文化,更是品健康和效应
2017-09-16 -

提升服务品质和工作效率 腾讯助医生获最大价值
2017-04-20 -

马化腾:“互联网+”将为实体经济创造新机会
2017-04-20 -

周其仁:“互联网+”要能解决中国的实际问题
2017-04-20 -

中国康复技术转化及发展促进会第三次会员代表大会在京召开
2016-11-08
-
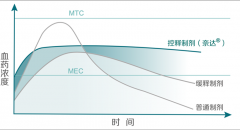
2022国家医保目录调整:首次纳入渗透泵控释型降糖药二甲双胍奈达
2023-01-19 -
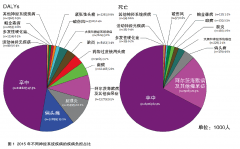
神经系统疾病负担不断增加
2017-09-28 -
【好书推荐】《实用肺功能检查手册 原书第5版》
2022-05-06 -
甘肃|天祝县特色医药产业发展稳中有进
2023-05-11 -
搭建AFS科学诊疗引擎 提升我国抗真菌药物管理水平 | 第一届抗真菌药物管理(AFS)高峰论坛举办
2022-09-24 -

胃旁路术后12年 体重减轻和糖尿病缓解仍维持
2017-09-28 -

周其仁:“互联网+”要能解决中国的实际问题
2017-04-20






