中国抗癌药临床Ⅰ期试验“揭家底”

2月,《柳叶刀·肿瘤学》发表了《中国肿瘤学Ⅰ期临床试验年度报告》,中山大学肿瘤防治中心张力教授和北京大学肿瘤医院的沈琳教授为共同通讯作者。报告围绕180项2017年在研的肿瘤学Ⅰ期临床试验,针对研究机构分布、研究设计、人群筛选策略、研究癌种以及研究靶点展开分析,结合政府药品监管政策的改革,提出中国抗肿瘤药物研发的挑战、趋势与对策。该报告是2018年1月,由张力教授领衔,中国肿瘤学Ⅰ期临床试验联盟对中国大陆2017年肿瘤学领域的Ⅰ期临床试验现状进行的全面调查。(Lancet Oncol. DOI: 10.1016/S1470-2045(18)30865-9)

挑 战
1、Ⅰ期临床试验机构数目不足、分布不均
2017年中国大陆在研的Ⅰ期临床试验数目达180项,仅次于欧洲的241项。然而,180项Ⅰ期临床试验仅由18所研究机构承接,其中的前5所研究机构完成了59%的项目;73%的Ⅰ期试验发生在北京、上海、广州。
2、缺乏协作组织,研究者、申办方及CRO间交流合作困难重重
研究者、申办方与CRO间的充分交流与合作是推动临床试验顺利开展与进行的重要因素之一。Ⅱ/Ⅲ期临床试验的协作组织早在2007年成立,并推动了数项大型临床试验的完成。但直至2017年,中国的Ⅰ期临床试验仍缺乏类似组织,研究者、申办方及CRO之间的交流合作壁垒重重。
3、试验设计重复低效 人群筛选与研究癌种未考虑中国患者特征
在180项试验中,仅有16项(9%)为新疗法的首次人体试验。
由跨国药企资助的试验均为药代动力学/药效动力学试验,其中过半为旨在加快药品审批的桥接试验。
在研究人群筛选方面,仅1项针对PD-1/PD-L1抗体的研究(CTR20171020)允许HBV阳性的患者(HBV DNA≤500 U/ml)入组;其余28项研究均照搬国外的设计,排除HBV阳性患者。
在研究癌种方面,胃癌、肝癌、食管癌及鼻咽癌为中国特有的四大癌种。在116项研究特定癌种的Ⅰ期试验中,仅12项试验针对此4种肿瘤。
4、国内药企专注开发改良型新药 Ⅰ期试验中新分子实体少见
在被药品审评中心列为“1类新药”的国产药中,大部分为改良型新药,少见由国内制药公司独立开发的新分子实体。
以小分子靶向药物为例,目前至少有18种国产的EGFR-TKI在同时开发,均被列为“1类新药”;然而其中只有2种为国内独立研发的新分子实体。
类似的情况也见于PD-1/PD-L1抗体。
进 展
2017年也是中国药物研发的变革之年,在报告中,研究小组也针对中国抗肿瘤药物研发的趋势与进展进行了分析。
1、国家改革药品审评、监管制度,大力推动生物医药创新
2017年以来,国家实施了一系列改革措施,其中包括:
废除目前的临床试验机构认证系统;实施临床试验60日默示许可制度;严厉打击临床试验数据造假;加强药品上市后监管;允许进口新药在中国境内外同步开展Ⅰ期临床试验等。
2、中国肿瘤学Ⅰ期临床试验联盟促进Ⅰ期临床试验开展
Ⅰ期联盟旨在提供专业知识和经验交流平台,打破壁垒,促进Ⅰ期临床试验研究者、申办方与CRO之间的交流与合作。
联盟每年定期发布肿瘤学Ⅰ期临床试验报告;每年举行两次峰会,邀请国家药品审评中心专家、国内肿瘤学家、申办方与CRO代表参会。
3、中国药企重心移至新药研发 创新研究设计涌现
在2017年,89%的肿瘤学Ⅰ期临床试验由国内的制药企业资助;其中的领跑者包括和记黄埔、江苏恒瑞、百济神州、上海君实和基石药业等。27%的Ⅰ期试验进行了生物标志物的探索。在免疫治疗方面,由张力教授领衔的我国自主研发的PD-1单抗的两项Ⅰ期临床试验结果近日也在《柳叶刀·肿瘤学》上发表,该研究开创性地探索了PD-1单抗联合顺铂、吉西他滨方案一线治疗复发及转移鼻咽癌的临床疗效,其结果有望改写晚期鼻咽癌的治疗模式。
该报告是第一份关于中国肿瘤学Ⅰ期临床试验系统报告,在后续的调查中,Ⅰ期联盟将有望通过纵向对比,进一步描绘与分析中国抗肿瘤药物研发的现状与趋势。
发表评论
最新评论

-
04-292025
人工智能诊疗将走向前台——医生做好准备了吗
-
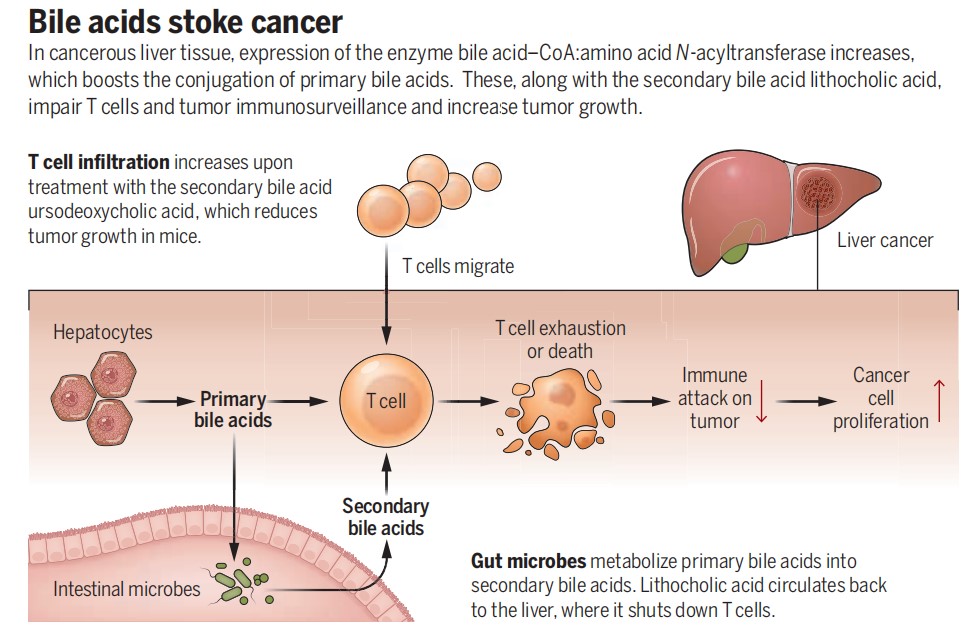
new肝癌免疫治疗的“路障”:胆汁酸 | 科普时光
2025-03-07 -
02-172025
慢病管理药先行 临床药师如何打通最后一公里
-

new双镜合壁 助力消化疾病微创精准治疗
在精准治疗、功能保护越来越多地被重视的情况下,内镜与腹腔镜“双镜联合”成为胃肠疾病诊疗的一种趋势。
2024-12-24
-

双镜合壁 助力消化疾病微创精准治疗
2024-12-24 -

朱玉龙:严重肺间质纤维化患者肺部结节经皮穿刺活检的注意事项
2024-11-21 -

IDSC感染专栏54③|重症感染患者弥散性血管内凝血早期诊断:中国诊断积分系统CDSS显优势
2022-06-28 -
IDSC感染专栏54②|夏秋季的烦恼,这种介于细菌与病毒间的病原在我国有抬头之势
2022-06-28 -
IDSC感染专栏54①|二代测序预测革兰阳性球菌耐药性有新发现
2022-06-28
-

何为巴林特小组?一文读懂
2017-02-23 -

IDSC感染专栏54③|重症感染患者弥散性血管内凝血早期诊断:中国诊断积分系统CDSS显优势
2022-06-28 -
益生菌预防艰难梭菌感染真的有效吗?
2021-09-07 -
孩子不是大人“缩微版” 小儿妇科聚焦未成年女性健康
2023-05-30 -

倪晓光:用好手中喉镜 提升鼻咽喉早癌检出率
2023-03-07 -
赵进喜教授:发挥中医药防治糖尿病肾脏病的特有优势
2023-06-09 -

心血管代谢医学|将临床研究融入社区日常临床诊疗以提高医学服务水平和质量
2021-11-05






