益生菌预防艰难梭菌感染真的有效吗?
本文作者:南通市第一人民医院 李培
艰难梭菌 (CD) 是医院和社区感染性腹泻,尤其是伪膜性肠炎等相关疾病的重要病原体。艰难梭菌感染 (CDI)已成为全球公共卫生威胁,愈发受到关注。益生菌被定义为“活的微生物,当给予足够量时,会给宿主带来健康益处”[1]。在临床上,益生菌常被用于接受抗菌药物治疗患者的CDI一级预防或正在接受CDI治疗以防复发的二级预防[2]。支持这一适应证的证据主要来自荟萃分析。但这些荟萃分析因不同益生菌配方、不同研究方法和条件、不同抗菌药物治疗、以及试验数据规模过小导致偏倚严重,结果的变异性高,缺乏说服力。
益生菌预防艰难梭菌感染效果存疑
通常认为,益生菌活性的分子机制是在其应用部位由微生物和上皮细胞相互作用触发。主要机制包括抑制细菌生长,如通过细菌素分泌、短链脂肪酸的产生、降低pH值抑制细菌生长,抑制细菌毒力因子表达,防止病原菌定植,调节一个或多个黏膜和(或)系统免疫反应,和(或)改善胃肠道屏障完整性[3,4]。某些益生菌可抑制核因子kappaB的激活,从而抑制黏膜和/或全身的促炎免疫反应[5,6]。益生菌作为膳食补充剂在市场销售,带有“改善肠道健康、提供天然益处”的宣传。这产生了巨大吸引力,由此每年创造400亿美元的产业[7]。
在临床上,益生菌常被用于接受抗菌药物治疗患者的CDI一级预防或正在接受CDI治疗以防复发的二级预防。Placide研究是迄今规模最大的益生菌一级预防双盲临床研究[8]。该研究招募了近3000例正在接受抗菌药物治疗的老年住院患者,将他们随机分配到由双歧杆菌和嗜酸乳杆菌菌株组成的多菌种制剂(n=1493)或安慰剂(n=1488)治疗21 d。主要研究结果是抗菌药物相关性腹泻(AAD)或CDI的发生率。益生菌组有159例(10.8%)、安慰剂组有153例(10.4%)发生AAD或CDI(RR=1.04,P=0.71),由此作者得出益生菌对预防AAD或CDI没有益处的结论。Placide研究的益生菌组和安慰剂组分别有12例(0.8%)和17例(1.2%)发生CDI,患者群CDI的发生率较低,因此可能无法显示益生菌预防CDI的益处。
一项包括Placide研究在内的RCT研究的荟萃分析,也得出益生菌在住院老年人群中预防CDI没有显著益处的结论[9]。2017年的Cochrane研究综述了益生菌在抗菌药物治疗的成人和儿童CDI一级预防,纳入了31项研究,共计8672例患者[10]。其中有27项研究被认为有很高或不清楚的偏倚风险,超半数研究有数据缺失。虽然作者得出益生菌有一定益处的结论,但亚组分析发现,仅基线CDI风险>0.5%的患者获益。这篇Cochran综述的结论被批评存在误导性[11],因为31项研究中仅4项显示获益,而且纳入了小型的、质控欠佳的研究,其结果受到CDI基线风险>15%的5项研究的严重影响,这一基线风险远远高于世界上任何一家医院的水平。
另一项荟萃分析专门探究了一种特殊的益生菌组合,该组合由嗜酸乳杆菌、干酪乳杆菌和鼠李糖乳杆菌3个乳杆菌菌株组成;该组合在体外被发现有抑制艰难梭菌的作用[12]。3个RCT研究中,仅一项中国的接受抗菌药物治疗的老年患者研究显示该组合对CDI一级预防有效[13]。但该研究中CDI的背景发病率极高(近24%,34例),这一比率在大多数医疗保健机构中都很少见。
最近,一项对19个RCT研究的荟萃分析得出结论,益生菌在抗菌药物治疗的2 d内开始使用,CDI风险降低70%;在抗菌药物治疗2 d后开始使用,CDI风险降低30%[14]。但这些研究排除了包括免疫受损、接受癌症治疗、ICU或存在胃肠道疾病的患者。
2017年发表的PICO研究将33例最初患有轻中度CDI的患者随机分为在抗CDI治疗的基础上服用4种益生菌或安慰剂共计28 d,没有观察到组间CDI复发率的差异[15]。布拉酵母菌是一种生长在荔枝果实上的酵母菌,它能产生一种蛋白酶,使艰难梭菌毒素A的受体位点失活,为其在CDI中的应用提供了生物学可能性。1994年发表的一项多中心双盲RCT研究显示,在有复发经历的患者中,接受布氏酵母菌治疗的患者CDI复发率降低(RR=0.43,34.6%与64.7%);但在接受初始CDI治疗的患者中,与安慰剂比没有获益[16]。作者后续随访发现这项研究中的复发率降低仅限于接受大剂量万古霉素和布氏酵母菌治疗的亚组(16.7%与50%)[17]。该研究规模很小,大剂量万古霉素组只有32例患者,无法由此得出可靠的结论。
临床医生最关注的是抗菌药物治疗期间或之后服用益生菌是否促进抗菌药物副反应的恢复。但目前关于抗菌药物的抗菌谱对微生物菌群的影响、以及对益生菌使用的影响信息有限。同样,对益生菌如何、以及是否改变肠道微生物菌群了解有限。近年的研究发现,抗菌药物暴露后,益生菌在肠道微生物菌群重建过程中的作用存在个体差异,甚至可能延迟结肠正常微生物菌群的恢复[18,19]。
缺乏严格监管 三成以上益生菌产品或与标签信息不一致
在美国,即使没有疗效数据,益生菌也可以获得FDA的“GRAS(generally recognized as safe)”。GRAS物质是指那些“在食品中使用、有经过证明的安全记录的物质”。其依据是1958年之前的使用历史或已发表的科学证据,在使用前无需FDA批准。
由于缺少类似药品的严格监管,益生菌不受最低制造标准的约束,也无需在销售益生菌产品时进行证明功效的科学研究。对市场上销售的益生菌制剂的组成研究发现,至少30%的产品存在实际活菌数量、生物体浓度、类型和产品标签上提供的信息不一致[20]。此外,益生菌产品的标签还存在分类错误或虚构的微生物名称;无法存活的菌株、受污染的产品或功能特性降低也较为常见[21]。虽然益生菌通常被认为是安全的,但目前的研究尚不足以说明益生菌安全性问题,在脆弱的患者尤其如此,如高龄、危重、早产儿、免疫抑制、短肠综合征、心脏瓣膜异常、以及静脉导管、假体材料或装置植入患者。
一项益生菌治疗胰腺炎的临床试验(PROPATRIA研究)引发了临床医生对益生菌安全性的关注[22]。这是一项旨在评估益生菌制剂(6种不同的乳杆菌或双歧杆菌菌株,每天总剂量1010个细菌)对急性胰腺炎感染并发症的有效性的随机、双盲、安慰剂对照研究,益生菌组的死亡率显著增加(16%,152例与6%,144例,RR=2.53),但对感染并发症没有任何可测量的影响。这项研究中,益生菌治疗组继发于肠缺血的死亡率显著增加。虽然这一不良后果的机制尚不清楚,但该试验被认为是益生菌造成有害影响的一个例子。
目前尚没有足够的证据推荐任何益生菌用于CDI的一级预防或二级预防。益生菌尚未获得任何CDI标准预防和治疗的推荐,美国FDA也未批准任何用于疾病治疗和预防的益生菌。益生菌在CDI治疗和预防中的作用仍有待更多有严格质控的基础和临床研究来给出答案。
参考文献
1、 Gibson GR, Hutkins R, Sanders ME, et al. Expert consensus document: the International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat Rev Gastroenterol Hepatol.2017;14:491–502.
2、 Williams MD, Ha CY, Ciorba MA. Probiotics as therapy in gastroenterology: A study of physician opinions and recommendations. J Clin Gastroenterol 2010;44:631–6.
3、 Bron PA, Kleerebezem M, Brummer RJ, et al. Can probiotics modulate human disease by impacting intestinal barrier function? Br J Nutr.2017;117:93–107.
4、 Patel R, DuPont HL. New approaches for bacteriotherapy: prebiotics, new-generation probiotics, and synbiotics. Clin Infect Dis. 2015;60 Suppl2:S108–S121.
5、 Mumy KL, Chen X, Kelly CP, et al. Saccharomyces boulardii interferes with Shigella pathogenesis by postinvasion signaling events. Am J PhysiolGastrointest Liver Physiol. 2008;294:G599–G609.
6、 Voltan S, Martines D, Elli M, et al. Lactobacillus crispatus M247-derived H2O2 acts as a signal transducing molecule activating peroxisome proliferator activated receptor-gamma in the intestinal mucosa. Gastroenterology.2008;135:1216–1227.
7、 Research ZM. Probiotics market: Size, share & trends analysis report by ingredient type (bacteria and yeast), by form (liquid probiotic and dry probiotic), by application (food & beverages, dietary supplements, and animal feed), by end user (human probiotics and animal probiotics): Global industry perspective, comprehensive analysis, and forecast, 2019–2026. 2020.
8、 Allen SJ, Wareham K, Wang D, et al. A high-dose preparation of lactobacilli and bifidobacteria in the prevention of antibiotic-associated and Clostridium difficile diarrhoea in older people admitted to hospital: A multicentre, randomised, double-blind, placebo-controlled, parallel arm trial (PLACIDE). Health Technol Assess 2013;17:1–140.
9、 Vernaya M, McAdam J, Hampton MD. Effectiveness of probiotics in reducing the incidence of Clostridium difficile-associated diarrhea in elderly patients: A systematic review. JBI Database System Rev Implement Rep 2017;15:140–64.
10、 Goldenberg JZ, Yap C, Lytvyn L, et al. Probiotics for the prevention of Clostridium difficile-associated diarrhea in adults and children.Cochrane Database Syst Rev 2017;12:CD006095.
11、 Freedman SB, Schnadower D, Tarr PI. The probiotic conundrum: Regulatory confusion, conflicting studies, and safety concerns. JAMA 2020;323:823–4.
12、 McFarland LV, Ship N, Auclair J, et al. Primary prevention of Clostridium difficile infections with a specific probiotic combining Lactobacillus acidophilus, L. casei, and L. rhamnosus strains: Assessing the evidence. J Hosp Infect 2018;99:443–52.
13、 Gao XW, Mubasher M, Fang CY, et al. Dose-response efficacy of a proprietary probiotic formula of Lactobacillus acidophilus CL1285 and Lactobacillus casei LBC80R for antibiotic-associated diarrhea and Clostridium difficile-associated diarrhea prophylaxis in adult patients.Am J Gastroenterol 2010;105:1636–41.
14、 Viggars AP, Gracie DJ, Ford AC. Use of probiotics in hospitalized adults to prevent Clostridium difficile infection: DownGRADE the quality of evidence? Gastroenterology 2017;153:1451–2.
15、 Barker AK, Duster M, Valentine S, et al. A randomized controlled trial of probiotics for Clostridium difficile infection in adults (PICO). JAntimicrob Chemother 2017;72:3177–80.
16、 McFarland LV, Surawicz CM, Greenberg RN, et al. A randomized placebo-controlled trial of Saccharomyces boulardii in combination with standard antibiotics for Clostridium difficile disease. JAMA 1994; 271:1913–8.
17、 Surawicz CM, McFarland LV, Greenberg RN, et al. The search for a better treatment for recurrent Clostridium difficile disease: Use of high-dose vancomycin combined with Saccharomyces boulardii. Clin Infect Dis 2000;31:1012–7.
18、 Zmora N, Zilberman-Schapira G, Suez J, et al. Personalized gut mucosal colonization resistance to empiric probiotics is associated with unique host and microbiome features. Cell. 2018;174:1388–1405, e21.
19、 Suez J, Zmora N, Zilberman-Schapira G, et al. Post-antibiotic gut mucosal microbiome reconstitution is impaired by probiotics and improved by autologous FMT. Cell. 2018;174:1406–1423, e16.
20、 Hoffman FA, Heimbach JT, Sanders ME, et al. Executive summary: scientific and regulatory challenges of development of probiotics as foods and drugs. Clin Infect Dis. 2008;46 Suppl 2:S53–S57.
21、 Weese JS. Evaluation of deficiencies in labeling of commercial probiotics. Can Vet J. 2003;44:982–983.
22、 B esselink MG, van Santvoort HC, Buskens E, et al. Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial. Lancet. 2008;371:651–659.
发表评论
最新评论

-
new教师节特辑 | 北京医院刘明主任寄语:“敬畏生命、敬畏专业、敬畏未知”
2025-09-10 -
04-292025
人工智能诊疗将走向前台——医生做好准备了吗
-
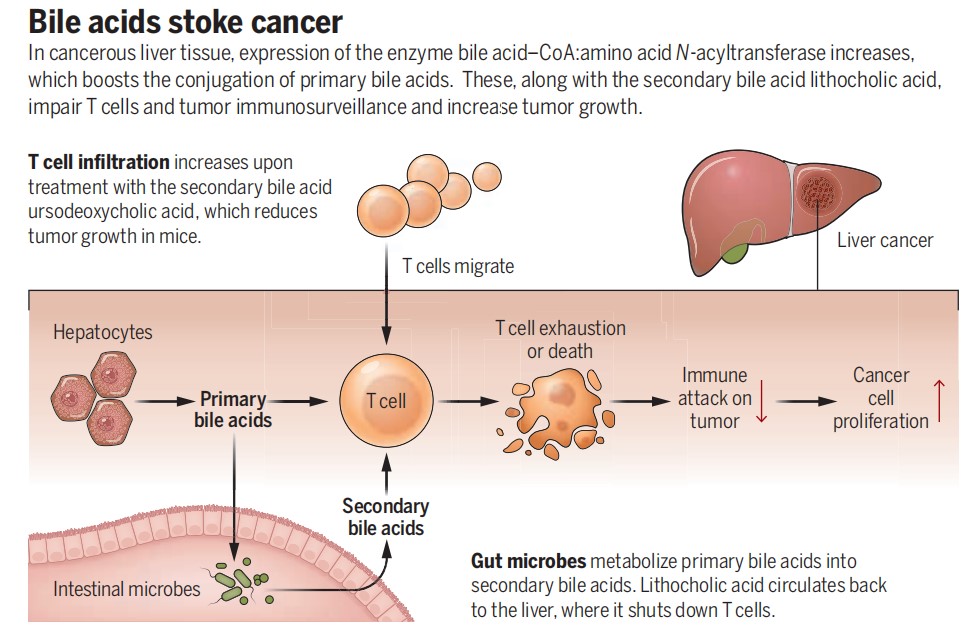
new肝癌免疫治疗的“路障”:胆汁酸 | 科普时光
2025-03-07 -
02-172025
慢病管理药先行 临床药师如何打通最后一公里
-

双镜合壁 助力消化疾病微创精准治疗
2024-12-24 -

朱玉龙:严重肺间质纤维化患者肺部结节经皮穿刺活检的注意事项
2024-11-21 -

IDSC感染专栏54③|重症感染患者弥散性血管内凝血早期诊断:中国诊断积分系统CDSS显优势
2022-06-28 -
IDSC感染专栏54②|夏秋季的烦恼,这种介于细菌与病毒间的病原在我国有抬头之势
2022-06-28 -
IDSC感染专栏54①|二代测序预测革兰阳性球菌耐药性有新发现
2022-06-28
-

何为巴林特小组?一文读懂
2017-02-23 -

IDSC感染专栏54③|重症感染患者弥散性血管内凝血早期诊断:中国诊断积分系统CDSS显优势
2022-06-28 -
益生菌预防艰难梭菌感染真的有效吗?
2021-09-07 -
孩子不是大人“缩微版” 小儿妇科聚焦未成年女性健康
2023-05-30 -

倪晓光:用好手中喉镜 提升鼻咽喉早癌检出率
2023-03-07 -
赵进喜教授:发挥中医药防治糖尿病肾脏病的特有优势
2023-06-09 -

心血管代谢医学|将临床研究融入社区日常临床诊疗以提高医学服务水平和质量
2021-11-05






