重磅发布|程颖教授:塞普替尼中国数据为RET融合阳性NSCLC患者注入一针“强心剂”

近年来,基于全球I/II期LIBRETTO-001研究的系列结果出炉,为RET融合患者带来希望。突破性疗法、加速审批、全球首个获批等关键词赋予了塞普替尼更多的治疗意义,并已在多个国家被批准用于治疗局部晚期或转移性RET融合阳性非小细胞肺癌(NSCLC)及甲状腺癌,RET突变的甲状腺髓样癌(MTC)。
除此之外,基于它在泛瘤种中的出色表现,今年9月21日FDA优先审评并加速批准塞普替尼作为首个且唯一RET抑制剂,不限癌种用于RET基因融合的晚期或转移性实体瘤成人患者[2]。在中国,9月30日,塞普替尼获得国家药品监督管理局(NMPA)加速批准,用于治疗转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者、需要系统性治疗的晚期或转移性RET突变型甲状腺髓样癌(MTC)成人和12岁及以上儿童患者、以及需要系统性治疗且放射性碘难治(如果放射性碘适用)的晚期或转移性RET融合阳性甲状腺癌(TC)成人和12岁及以上儿童患者。需要指出的是,塞普替尼目前在中国是唯一一款获批用于肺癌一线治疗的RET抑制剂。
此次在中国获批的三项适应症,主要基于全球研究LIBRETTO-001系列数据和LIBRETTO-321研究的中国人群数据。前有LIBRETTO-001的系列优秀研究数据的不断迭代,后有吉林省肿瘤医院程颖教授、上海交通大学附属胸科医院陆舜教授、天津市人民医院高明教授共同领衔专门针对中国人群的LIBRETTO-321肺癌部分数据出炉,进一步证实了中国数据与全球数据保持的一致性,结果充分显示塞普替尼在中国RET融合阳性NSCLC 患者人群中的良好疗效和安全性,为塞普替尼治疗中国RET融合阳性NSCLC患者注入一针“强心剂”。
《医师报》第一时间邀请程颖教授,一起走进LIBRETTO-321研究,走进非小细胞肺癌RET融合患者诊疗的探索之路。

直击痛点与难点
打破RET融合无精准靶向药物困境
RET基因融合是重要的NSCLC罕见驱动基因变异类型之一,虽然发生率仅占NSCLC患者的1-2%左右[1],但由于NSCLC患者总体基数大,所以针对于RET基因融合NSCLC患者的精准治疗具有较大的临床需求和研究价值。程教授介绍,在临床中,化疗和多靶点激酶抑制剂曾是RET基因融合患者在临床最常应用的治疗药物,但一线化疗中位生存期(mPFS)为 5.2~9.2个月,二线化疗mPFS 仅为2.8~4.9个月[3];而多靶点激酶抑制剂(如卡博替尼、舒尼替尼、索拉非尼和凡德他尼)对RET的靶向性低,不仅疗效有限还会因脱靶导致严重毒性;除此以外,免疫检查点抑制剂治疗RET改变患者的获益也差强人意。
因此,一直以来缺少RET特异性靶向药物是临床治疗过程中的痛点和难点,直到2020年才出现转机。随着特异性RET抑制剂塞普替尼和普拉替尼的问世,给RET融合NSCLC患者带来希望的曙光。塞普替尼和普拉替尼于2020年相继获得FDA批准上市,彻底打破了RET融合NSCLC无精准靶向药物的困境。
全球首个获批的高选择性RET抑制剂
连续四年数据不断迭代
LIBRETTO-001研究是首个公布结果的特异性RET抑制剂临床研究。在2018年ASCO年会上,第一次公布了塞普替尼治疗RET基因改变实体瘤1期研究的初步安全性和疗效数据。研究显示,38例NSCLC患者的客观缓解率(ORR)达到77%,显示出了强劲的抗肿瘤活性[4]。同年9月被FDA授予突破性疗法认定,用于治疗携带RET基因变异的NSCLC和甲状腺髓样癌(MTC)。
2020年ASCO会议上,该研究更新报告了105例经治和39例初治RET融合NSCLC患者的研究结果,并在2020年8月发表于《新英格兰医学杂志》,结果显示,105例既往接受过含铂化疗的RET融合NSCLC患者的ORR为64%,mPFS为16.5个月,中位缓解率(mDoR)为17.5个月,mDOR超过6个月的患者比例为81%。39例初治患者的ORR为85%,mDoR超过6个月的患者比例为90%[5]。基于该研究结果,FDA于2020年5月8日加速批准上市,用于治疗RET融合阳性的NSCLC和甲状腺癌,以及RET突变MTC,成为全球首个获批的高选择性RET抑制剂。
2022年9月《临床肿瘤学杂志》再次发表了该研究更大样本量的更新数据,247例铂类经治患者的ORR为 61%,mPFS为24.9个月,mDoR为28.6个月;69例初治患者的ORR 为84%,mPFS为22.0个月,mDoR为20.2个月[6]。
数据亮点
患者持续获益和高效的脑转移控制率
在LIBRETTO-001试验中,如果根据研究者(INV)评估患者有持续获益并经申办方批准,允许患者在病情进展(PD)后继续使用塞普替尼。今年的ESMO会议上,LIBRETTO-001研究公布了PD后继续使用塞普替尼治疗NSCLC患者中安全性和有效性的事后探索性分析数据,结果显示,在INV评估为进展的169例RET融合NSCLC患者中,120例(71%)在PD后继续使用塞普替尼(包括86例铂类经治和22例初治)。PD前和PD后的中位治疗持续时间分别为10.9个月和5.0个月。在PD后6个月和9个月,仍有45%和34.3%的患者接受治疗;在120例PD后患者中,40例(33%)接受了局部治疗,其中36例接受了放疗(12例接受了脑部放疗)[7]。这40例患者在PD后治疗的中位时间为5.4个月,安全性与总体人群基本一致。这项更新的数据提示,RET融合NSCLC患者在PD后似乎可从继续使用塞普替尼治疗中获得持续的临床获益。程颖教授表示,虽然仅为探索性的事后分析,但对于临床医生进行治疗决策有一定的借鉴意义,未来仍需要进一步的数据分析给临床选择提供更多的循证医学依据。
另外,塞普替尼在临床前模型中就显示良好的血脑屏障穿透能力,在已经发表的LIBRETTO-001研究的脑转移人群数据中,80例患者在基线时有脑转移,其中56%接受≥1个疗程的颅内放射治疗(14%全脑放射治疗,45%立体定向放射治疗)。22例基线有可测量颅内病灶的患者中,颅内ORR为82%,23%的患者获得CR,59%获得PR,18%为SD。其中,既往未接受中枢神经系统放疗的患者(n=14)ORR为86%,29%达到CR,57%为PR,14%为SD;既接受过中枢神经系统放疗的患者ORR为75%,CR达13%,PR为63%,SD为25%。所有80例患者的中位颅内PFS为13.7个月[8]。
LIBRETTO-001的最新数据显示,在106例基线时脑转移患者中,中位随访时间为22.1个月,中位颅内PFS为19.4个月。在基线有可测量颅内病灶的患者中(n=26),颅内ORR为85%,CR为27%。无论患者之前是否接受过全身治疗或放疗,均观察到客观反应。此外,在22例有可测量的CNS转移的应答者中,中位DOR为9.4个月[6]。
LIBRETTO-321研究中纳入了5例基线有可测量脑转移病灶的患者,其中4例达到了CR或PR,显示塞普替尼具有高效的脑转移控制效果[8]。上述研究数据提示塞普替尼可以作为RET融合阳性NSCLC脑转移患者治疗的新选择,也为临床治疗脑转移患者时选择用药增添了信心,期待塞普替尼尽早纳入医保目录,增加中国RET融合阳性患者的药物可及性,造福更多患者。
中国数据与全球数据高度保持一致
LIBRETTO-321研究是在中国晚期RET变异实体瘤患者中开展的开放标签、多中心2期研究,共入组77例患者,其中47例为RET融合NSCLC,吉林省肿瘤医院作为CO-PI单位在2020年3月成功入组了首例患者。程颖教授高兴的指出,研究结果显示中国人群的数据与全球数据相似,队列1中26例NSCLC患者经中心实验室确认为RET融合阳性,纳入主要分析集(PAS)。研究结果显示,在中位随访9.7个月时IRC评估的ORR为69.2%,其中初治和经治患者的ORR分别为87.5%和61.1%,中位DoR未达到,94.4%的患者仍在持续缓解中,中位PFS和OS均未达到;所有NSCLC患者(n=47)的ORR为66.0%,初治和经治患者的ORR分别为90.9%和58.3%;常见的≥3级治疗相关AE为高血压、AST升高和ALT升高[8]。
程颖教授总结道:总体来看,塞普替尼在中国晚期RET融合阳性NSCLC患者中具有优异的抗肿瘤活性,并且耐受性良好,这与先前报道的LIBRETTO-001研究结果一致。基于塞普替尼在全球LIBRETTO-001研究和中国LIBRETTO-321研究中的优异表现,2022年9月30日NMPA批准其上市,用于治疗RET基因融合阳性的局部晚期或转移性NSCLC患者,为中国第一个获得一线NSCLC适应症的高选择性RET抑制剂,将进一步增加RET抑制剂在我国的临床可及性,也为临床医生和患者在制定治疗决策时带来了更多的治疗选择,也将给中国患者带来更多的生存获益。
在临床实际应用过程中,准确筛选出RET融合的NSCLC患者是开展精准治疗的重要前提,因为RET抑制剂在我国刚上市不久,开展RET检测的起步较晚,存在缺乏统一规范标准、检测项目未纳入医保、临床医生缺乏检测意识、很多医疗机构因缺少仪器设备和技术人员无法独立开展等问题;此外,由于药物价格昂贵且未纳入医保目录,一定程度上限制了其在临床应用的普及性,需要推动更多的RET抑制剂进入临床。除药物可及性以外,RET抑制剂的耐药也是目前困扰临床的棘手难题,常见的耐药机制包括RET G810突变、MET扩增、KRAS扩增等,目前还缺乏有效的克服耐药对策。
发表评论
最新评论

-
new教师节特辑 | 北京医院刘明主任寄语:“敬畏生命、敬畏专业、敬畏未知”
2025-09-10 -
04-292025
人工智能诊疗将走向前台——医生做好准备了吗
-
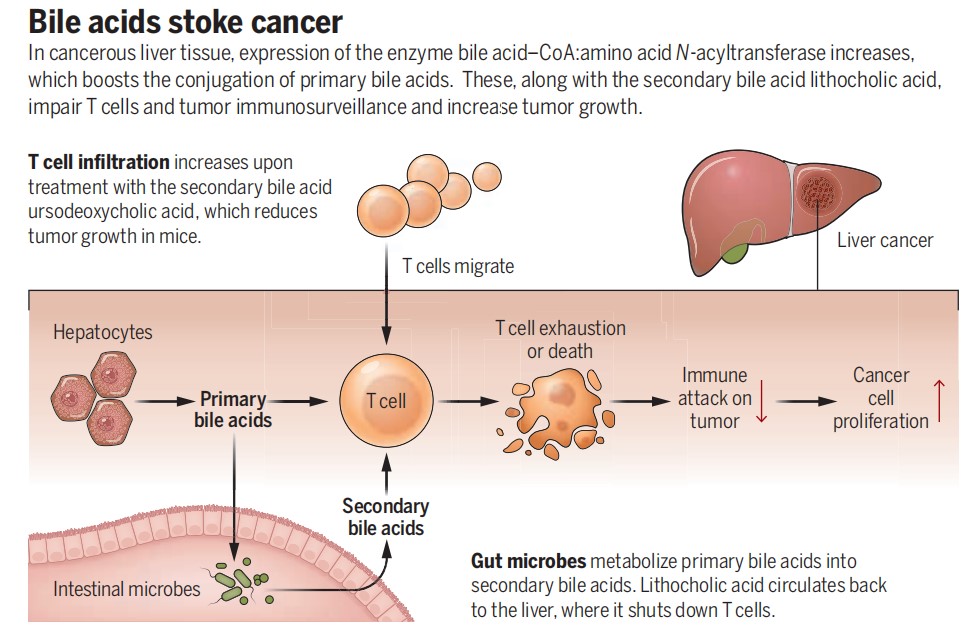
new肝癌免疫治疗的“路障”:胆汁酸 | 科普时光
2025-03-07 -
02-172025
慢病管理药先行 临床药师如何打通最后一公里
-

双镜合壁 助力消化疾病微创精准治疗
2024-12-24 -

朱玉龙:严重肺间质纤维化患者肺部结节经皮穿刺活检的注意事项
2024-11-21 -

IDSC感染专栏54③|重症感染患者弥散性血管内凝血早期诊断:中国诊断积分系统CDSS显优势
2022-06-28 -
IDSC感染专栏54②|夏秋季的烦恼,这种介于细菌与病毒间的病原在我国有抬头之势
2022-06-28 -
IDSC感染专栏54①|二代测序预测革兰阳性球菌耐药性有新发现
2022-06-28
-

何为巴林特小组?一文读懂
2017-02-23 -

IDSC感染专栏54③|重症感染患者弥散性血管内凝血早期诊断:中国诊断积分系统CDSS显优势
2022-06-28 -
益生菌预防艰难梭菌感染真的有效吗?
2021-09-07 -
孩子不是大人“缩微版” 小儿妇科聚焦未成年女性健康
2023-05-30 -

倪晓光:用好手中喉镜 提升鼻咽喉早癌检出率
2023-03-07 -
赵进喜教授:发挥中医药防治糖尿病肾脏病的特有优势
2023-06-09 -

心血管代谢医学|将临床研究融入社区日常临床诊疗以提高医学服务水平和质量
2021-11-05






