

病例摘要
主诉 男性,39岁。主因“左桡动脉搏动减弱18年,蛋白尿3年,发热1个月”入院。
现病史 患者在1992年体检时发现左侧桡动脉搏动减弱,左上肢血压无法测出。
2004年初,无明显诱因头痛,测右上肢血压为180/60 mm Hg,左上肢未及。颈部血管超声:双颈动脉内径缩小,锁骨下动脉起始处狭窄。超声心动图:左心扩大,左室肥厚,主动脉瓣重度关闭不全,二尖瓣轻度关闭不全,主动脉窦升主动脉扩张。诊断为“大动脉炎”,未进一步诊治。
2007年就诊北京协和医院。尿常规示:尿蛋白 5.0 g/L,红细胞50个/μL;红细胞沉降率81 mm/h;白蛋白30 g/L。心脏血管造影:颈动脉多发管壁增厚,管腔不规则狭窄。考虑“大动脉炎”,给予泼尼松 40 mg、1次/d,缓慢减至25 mg,自行停药,环磷酰胺0.4 g、1次/周,共18个月,治疗效果不详。
2009年末,无明显诱因出现双下肢可凹性水肿,伴夜尿增多,3~5次/晚,服用利尿剂缓解水肿。
2010年2月起,间断出现夜间憋气,坐起可缓解,伴下肢水肿加重。7月查血常规正常,红细胞沉降率53 mm/h,白蛋白15.3 g/L。尿常规:尿蛋白(++++),24 h尿蛋白16 g。血管超声:颈动脉狭窄伴流速异常,左锁骨上动脉起始部狭窄;双侧腘动脉管壁不规则增厚。肾图检查:双肾血流灌注大致正常,排泄缓慢,肾小球滤过滤 63.68 ml/min。8月底加用泼尼松 60 mg,来氟米特10 mg、1次/d,治疗后无明显好转。4周后,每2周减用泼尼松5 mg。
入院前1个月,间断出现晨起发热,最高体温达39℃,伴畏寒、寒战,无咳嗽、咳痰、尿频、尿急等。当地间断给予头孢类抗感染治疗后暂时缓解,停药后体温复升。
患者自发病以来,记忆力较前明显下降,反应迟钝。近半年平地行走500 m即感双下肢疼痛无力,休息后可缓解。否认口腔、外阴溃疡,皮疹,雷诺现象,关节痛,肢端发凉,感觉异常等。
体格检查 血压:左上肢90/60 mm Hg,右上肢180/40 mm Hg。反应略迟钝,双下肢可见足癣、甲癣。双侧颈部及收缩期响亮杂音,左侧为著。主动脉瓣听诊区收缩期、舒张期3/6级杂音。双肱、桡动脉搏动可及,左侧较右侧弱,双侧股动脉、腘动脉、足背动脉搏动对称。周围血管征(+)、可及明显枪击音、水冲脉、毛细血管搏动征。双肺清,肝脾未及。双下肢轻度可凹性浮肿。
辅助检查 血常规:血红蛋白75 g/L。肝肾功能正常,白蛋白17 g/L,高脂血症。C反应蛋白50.0 mg/L,红细胞沉降率96 mm/h。补体正常。免疫指标:抗核抗体、抗盐水可提取性抗原多肽抗体谱、抗中性粒细胞胞浆抗体(-),血冷球蛋白(+)。
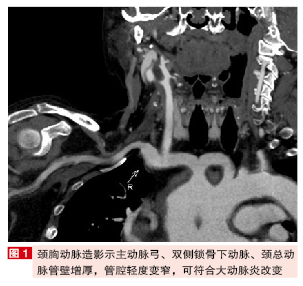
头颅CT:右顶叶、左额叶、左枕叶及胼胝体压部多发小圆形亚急性期梗死灶;左侧脑室前角小片慢性期缺血灶。经颅多普勒:左侧颈外、颈内、锁骨下动脉及左椎动脉、双侧大脑中动脉起始部狭窄、基底动脉多发狭窄。颈胸腹血管造影:主动脉弓、双侧锁骨下动脉、颈总动脉管壁增厚,管腔轻度变窄,可符合大动脉炎改变;肺动脉主干略增宽;降主动脉管壁多发钙化;腹主动脉管腔欠均匀。
肾脏方面:尿常规+沉渣:尿蛋白>3.0 g/L。尿潜血80个/μL,异形100%。24 h尿蛋白定量14.91 g。肾脏超声:双肾弥漫性病变。肾穿活检术后病理回报:膜增殖性肾小球肾炎。
入院后间断发热,最高温度38.5℃,伴畏寒,无明显寒战。两次血培养回报为血链球菌。经胸壁超声:感染性心内膜炎可能性大。经食道超声:主动脉瓣无冠瓣增厚,左室流出道面可见11×10 mm中等大小团块状回声,活动度小。二尖瓣前后叶稍增厚,左室流出道可见2条状中等强度回声,大小分别为7.6×4.2 mm、5.8×3.1 mm。
诊断 大动脉炎、感染性心内膜炎和膜增殖性肾小球肾炎。
治疗 入院后予罗氏芬2 g、1次/d抗感染治疗,复查血培养(-)。予泼尼松 50 mg、 1次/d,联合环磷酰胺0.2 g、隔日1次,雷公藤 20 mg、3次/d治疗。后因白细胞计数下降暂停环磷酰胺,之后加用吗替麦考酚酯 0.5 g、2次/d,同时应用环磷酰胺0.4 g 、每10~14 d一次。治疗6周复查24 h尿蛋白为8.24 g。考虑患者诊断明确,存在外科手术绝对指征,但手术风险极大,建议患者择期行手术治疗心脏病变。与患者及家属交待病情后,家属要求暂缓手术,出院观察。
诊治思考
患者病程18年,受累血管广泛,大动脉炎诊断较明确。红细胞沉降率、C反应蛋白均明显增高,提示病情仍处活动期。入院后积极治疗,复查炎症指标恢复正常,评估大动脉炎控制稳定。病程中出现大量蛋白尿,低白蛋白血症,符合肾病综合征,肾穿刺提示“膜增生性肾小球肾炎”。近期出现发热,查体可及心脏杂音,声象图提示“左室流出道,主动脉瓣上均可见多发的赘生物”,符合感染性心内膜炎诊断。
大动脉炎可致膜增生性肾小球肾炎
大动脉炎是一种主要影响主动脉及其主要分支的慢性进行性血管炎。文献显示,少部分大动脉炎患者可在肾脏继发淀粉样变,出现肾病综合征表现,但多为血清淀粉样物质A沉积于肾脏局部所致,血清蛋白电泳及免疫固定电泳一般不存在单克隆蛋白。
大动脉炎累及肾脏主要表现为肾血管性高血压和(或)缺血性肾病。大动脉炎合并肾小球疾病常见为系膜增殖性肾小球肾炎/IgA肾病,其次为膜增生性肾小球肾炎等。膜增生性肾小球肾炎分为原发和继发性肾小球肾炎,并以继发因素多见,包括感染、肿瘤、免疫疾病等。
本例患者有自身免疫性疾病大动脉炎,合并感染性心内膜炎,均可为膜增生性肾小球肾炎的继发因素。此外,自身免疫性疾病和感染性心内膜炎均可继发冷球蛋白血症,也可引起膜增生性肾小球肾炎。
大动脉炎病程长或更易合并肾脏病变
作者总结文献关于大动脉炎合并肾脏病变病例(17例)的临床特点发现,近3/4患者大动脉炎的病程超过10年,男女比例为4:13。多数患者在激素联合免疫抑制剂治疗1年内蛋白尿得到控制,肾功能稳定在正常范围。
北京协和医院总结了160例大动脉炎患者中6例合并肾小球疾病患者,平均年龄为35.5±10.0岁,均有下肢水肿症状,其中3例出现大量蛋白尿,2例出现轻度肾功能损害,1例患者肾穿刺病理为膜增生性肾小球肾炎,接受糖皮质激素+环磷酰胺治疗6个月后完全缓解。
病情稳定后限时行心脏手术
文献报道,大动脉炎合并主动脉瓣反流发生率约3%~25%,其主要机制为大动脉炎累及瓣膜,瓣膜增厚、变形引起反流,其次为大动脉炎累及主动脉根部,导致根部扩张,从而引起反流。
本例患者存在升主动脉、主动脉根部增宽,同时合并主动脉瓣重度反流。在瓣膜病变的基础上,由于长期低蛋白血症和免疫抑制治疗,患者免疫功能低下合并感染,出现感染性心内膜炎。
对于大动脉炎合并心脏瓣膜病,文献主要推荐手术治疗,但强调应在疾病稳定期进行,防止术后出现心血管相关并发症,如机械瓣脱落、吻合口瘘、感染风险高等。
本例患者“感染性心内膜炎”诊断明确,但糖皮质激素用量较大,外科手术风险大,建议静脉注射抗生素6~8周。若短期内无法手术,建议持续口服抗生素至手术清除病灶。近期患者出现夜间平卧时憋醒,活动后气促明显,考虑主动脉瓣关闭不全致心衰症状加重。心功能不全、瓣膜巨大赘生物均为明确的手术指征,但需确保大动脉炎病情不活动;此外,严重低蛋白血症影响术后伤口愈合、生长,推测术后感染及感染性心内膜炎复发风险高。
病例启示
郑文洁主任医师:这是一个诊断明确的多发大动脉炎患者,突出的特点是肾脏和心脏受累。大动脉炎影响这两个器官相对少见,在诊断和治疗中要加以重视和鉴别。患者诊治初期即有大量蛋白尿,肾脏受累,但不规范治疗及患者依从性较差,使肾脏病变未得到有效控制。长期低蛋白血症、不规律激素免疫抑制剂的使用,使其在心脏瓣膜病变的基础上合并感染性心内膜炎。治疗应双管齐下,在积极抗感染同时加强激素免疫抑制剂的治疗,创造手术条件,限期手术治疗。








