
尽管10年前抗血管生成治疗对于mRCC的标准治疗带来了革命性的变化,但过去的几年并未取得同样的成功。未来的几年人们将有希望通过对免疫检查点的阻断、新的靶向治疗以及分子驱动策略带来mRCC全身治疗的第二个春天,阐述mRCC的新的问题,迈出新的步伐,进一步接近治疗的终极目标——治愈转移性肾癌。
近年来,肾癌的发病率呈逐年攀升的态势,每年增长约2.5%。2012年统计数据显示,肾癌已成为我国十大恶性肿瘤之一,男性发病率为4~5/10万,女性为3~4/10万,是泌尿系统第二大肿瘤。
对于肾癌的致病因素,比较明确的有如下四点:一是遗传因素,二是过度肥胖,三是吸烟,四是化学致癌剂。另外,食品与环境污染也与肾癌的发病不无关系。
对于早期肾癌来说,手术是最重要的治疗手段,及早选择合适的手术方式对于肾癌的预后起到关键的作用;而对于进展期肾癌,尤其是转移性肾癌,需要以内科治疗为主的多学科综合治疗,从而最大限度的改善患者的生存。
“过去的辉煌”
2006年美国FDA批准舒尼替尼用于治疗转移性肾细胞癌(mRCC),揭开了晚期肾癌治疗的新篇章。在过去10年中,多种VEGF、VEGFR以及mTOR抑制剂已获得批准用于mRCC的治疗,目前已有7种靶向药物(舒尼替尼、索拉非尼、帕唑帕尼、阿昔替尼、依维莫司、替西罗莫司、贝伐珠单抗)应用于临床,同时还有更多的药物处于临床试验阶段。如何为患者选择最佳的靶向治疗方案,最大限度地延长患者的生命,是临床医生特别是内科医生的责任。
“如今的希冀”
近年来,肾癌患者的治疗获益已经达到了一个平台期。研究者致力于通过靶向药物的合理联合、序贯、增加剂量等来进一步改善治疗结果,但在标准治疗层面并未带来改变。随着免疫检查点阻断药物在mRCC治疗中引起关注,新的治疗突破指日可待。
免疫检查点阻断药物疗效凸显
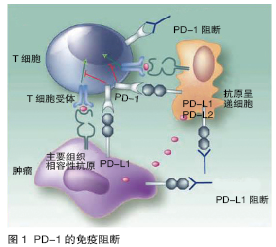
抗程序性死亡分子1 (PD-1,图1)通路的单克隆抗体的发展,无论单药或联合,都可能代表着未来的临床突破。
单药治疗
Nivolumab(PD-1的IgG4单克隆抗体)的Ⅰ期临床研究,首次报道了抗PD-1抗体在mRCC中的疗效。34例既往经过多线治疗的mRCC患者接受Nivolumab治疗,客观有效率可达29%,中位无进展生存(PFS)为7.3个月。
2014年美国临床肿瘤学会(ASCO)会议上报道了两项关于mRCC治疗的研究。一项研究随机入组168例既往VEGFR-TKI耐药的mRCC患者,随机分至Nivolumab 0.3 mg/kg、2 mg/kg、10 mg/kg组,三组的中位PFS为2.7~4.2个月,客观有效率为20%~22%,总生存期为18.2~25.5个月,该研究结果带来了很高的预期。同时,在另外一项平行的生物标志物研究中,Nivolumab采用相同剂量水平,并分别对VEGFR-TKI耐药和初治的mRCC患者进行多次的肿瘤活检。序贯的组织活检证实了Nivolumab诱导的免疫调剂效应,效应T细胞及其转录物的增加,γ干扰素诱导的血浆趋化因子(CXCL9和CXCL10)的增加都可以解释这一现象。
Nivolumab单药治疗对于mRCC患者总生存的影响将在一项Ⅲ期临床研究中报道,该研究计划入组800例VEGF/VEGFR抑制剂治疗失败的mRCC患者,对比Nivolumab及标准治疗依维莫司(NCT01668784)。
另一项可选的对于PD-1的相关抑制是抑制程序性死亡分子配体1(PD-L1),理论上抑制PD-L1的优势在于不影响PD-L1和PD-L2的相互作用,因而选择性更高。目前已有两种PD-L1的单抗在mRCC患者中进行了Ⅰ期临床研究。
联合治疗
由于这些免疫治疗药物作为单药使用耐受性良好,一项其与靶向药物联合的Ⅰ期临床研究CA 209-016(NCT 01472081)已经启动。该研究将受试者分为两组:Nivolumab 2 mg/kg 每3周,联合标准剂量的帕唑帕尼800 mg/d,另外一组是Nivolumab 2 mg/kg 每3周联合足量的舒尼替尼(50 mg 服药4周,停药2周)。在20例接受Nivolumab联合帕唑帕尼的患者中,观察到了4例剂量限制性毒性,因而该组研究未能按计划进行。Nivolumab联合舒尼替尼组共33例患者(包括扩大入组了19例初治患者)。该组患者观察到了积极的结果,52%的患者疗效达到经确认的部分缓解(PR),中位PFS为49周,在研究报道时大部分有效患者(59%)疗效仍在持续。
然而,联合治疗的安全性仍然是一个问题,71%~85%的患者出现了3/4度毒性,包括腹泻和肝肾毒性。
疗效预测因子
对于这些肾癌治疗新药,如何选择患者是决定性的、未能回答的问题之一。
免疫组化测定的PD-L1表达是目前出现的引人关注的预测因子,尽管其在mRCC患者中的预后价值已经在某种程度上确立,但其作为PD-1/PD-L1抑制剂疗效预测指标的作用尚未明确。
新的潜在靶点受关注
随着对抗血管生成药物耐药机制理解的深入,研究者也确定了一些新的潜在靶点,如MET、Ang-2、FGFR等。
在多个肿瘤模型中,VEGFR抑制后出现MET激活的上调,这被认为是抗肿瘤血管药物耐药的机理之一。在近期一项随机Ⅲ期对照研究METEOR(NCT01865747)中,入组了VEGFR-TKI耐药后的mRCC二线治疗患者,随机分为Cabozanitib(VEGFR和MET的小分子激酶抑制剂)组和依维莫司组,来评估在VEGF耐药的肾透明细胞患者中VEGFR/MET双重抑制的治疗策略。一项在中高危mRCC患者中一线使用Cabozanitib对照舒尼替尼的Ⅱ期临床研究(NCT01835158)也正在进行中。
如何确定与非VEGF驱动的新生血管形成相关的内皮细胞表面的其他分子靶点也是研究者关注的焦点。血管生成素(Ang-1、Ang-2)是Tie-1和Tie-2的配体,与缺氧诱导因子诱导的血管生成有关,并作用于血管生成和肿瘤生长。Trebananib是一个可抑制Ang/Tie2相互作用的融合蛋白,可与索拉非尼或舒尼替尼联合使用。在一项单臂的Ⅱ期临床研究中,80例患者接受舒尼替尼联合Trebananib(剂量为10 mg/kg或15 mg/kg,每周一次),两剂量组中位PFS分别为13.9个月和>16个月,结果令人鼓舞。Trebananib联合VEGF/VEGFR治疗包括贝伐珠单抗、舒尼替尼、索拉非尼、帕唑帕尼与Trebananib单药的对照研究(NCT01664182)正在进行中,希望该研究可使人们更深入的了解这种联合治疗。
对于非透明细胞癌,我们通过癌症基因组中乳头状肾细胞癌及嫌色细胞癌工作组提供的不断增加的肿瘤分子特征,对非透明细胞癌分类及治疗靶点有了更进一步的认识。在近期的大样本研究中,乳头状肾细胞癌中MET突变可占到15%~21%。在46%的Ⅱ型乳头状肾细胞癌患者中,46%可见到MET基因(位于7q31)拷贝数的变化,在Ⅰ型患者中,这一比例可达到81%,而基因拷贝数的变化与基因表达有显著的相关性。另外,近期新的包括MET的融合基因也在乳头状肾癌患者中得到了确认。两项Ⅱ期研究采用Foretinib和Tivantinib与厄罗替尼联合(NCT01688973)的结果令人鼓舞。在易位性肾癌中,新的融合基因包括ACTG-1-MTTF已经确定。但免疫检查点阻断在非透明细胞性肾癌中的作用仍未明确。








